题目内容
1.按要求填空:(1)写出下列元素的原子结构示意图:
Cr
 As
As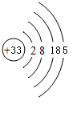
(2)写出下列元素的基态电子组态:
Fe1s22s22p63s23p63d64s2Zn1s22s22p63s23p63d104s2
(3)指明下列元素所处的区:
Css区Bip区Mnd区Cuds区.
分析 (1)Cr为24号元素,原子核中有24个质子,分别位于4个电子层上,价电子有6个电子,据此画出原子结构示意图;
As为33号元素,原子核中有33个质子,核外有33个电子,分别位于4个电子层,价电子有5个,处于第四周期第VA族,据此画出原子结构示意图即可;
(2)处于最低能量的原子叫做基态原子,基态电子排布遵循能量最低原理、保里不相容原理和洪特规则,根据元素符号,判断元素原子的核外电子数,再根据核外电子排布规律来写,以此解答该题;
(3)依据元素符号确定元素所在的周期数以及族序数,然后确定所在的区.
解答 解:(1)Cr为24号元素,原子核中有24个质子,分别位于4个电子层上,价电子有6个电子,故Cr的原子结构示意图为: ,As为33号元素,原子核中有33个质子,核外有33个电子,分别位于4个电子层,价电子有5个,处于第四周期第VA族,原子结构示意图为:
,As为33号元素,原子核中有33个质子,核外有33个电子,分别位于4个电子层,价电子有5个,处于第四周期第VA族,原子结构示意图为: ,
,
故答案为: ;
; ;
;
(2)Fe元素为26号元素,原子核外有26个电子,所以核外电子排布式为:1s22s22p63s23p63d64s2,Zn元素为30号元素,原子核外有30个电子,所以核外电子排布式为:1s22s22p63s23p63d104s2,故答案为:1s22s22p63s23p63d64s2;1s22s22p63s23p63d104s2;
(3)Cs处于周期表中第六周期第IA族,故为与s区,Bi位于第六周期第VA族,故属于p区,Mn位于第四周期第VIIB族,故属于d区; Cu位于第四周期第IB族,故属于ds区,故答案为:s区;p去;d区;ds区.
点评 本题考查核外电子排布规律,难度中等,注意构造原理写出元素基态原子的电子排布式,根据电子排布式分析.

练习册系列答案
相关题目
11.下列叙述错误的是( )
| A. | 在加热搅拌条件下加入MgO,可除去MgCl2溶液中的Fe3+ | |
| B. | pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 | |
| C. | 常温下,CH3COONa和CH3COOH的混合溶液中(pH=7):c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-) | |
| D. | 常温下,Cd(OH)2和Co(OH)2的混合悬浊液中,c(Cd2+)是c(Co2+)的3.5倍已知:KSP[Cd(OH)2]=7.2×10-15,KSP[Co(OH)2]=1.8×10-15 |
12.将一定质量的铁、氧化铁、氧化铜的混合物粉末放入100mL 4.40mol/L盐酸中,充分反应后产生896mL H2(标准状况),残留固体1.28g.过滤,滤液中无Cu2+.将滤液加水稀释到200mL,测得其中c(H+)为0.400mol/L.则原混合物中单质铁的质量是( )
| A. | 2.24g | B. | 3.36g | C. | 5.60g | D. | 10.08g |
9.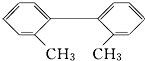 已知C-C键可以绕键轴自由旋转,对于结构简式为如图所示的烃,下列说法中正确的是( )
已知C-C键可以绕键轴自由旋转,对于结构简式为如图所示的烃,下列说法中正确的是( )
 已知C-C键可以绕键轴自由旋转,对于结构简式为如图所示的烃,下列说法中正确的是( )
已知C-C键可以绕键轴自由旋转,对于结构简式为如图所示的烃,下列说法中正确的是( )| A. | 分子中至少有8个碳原子处于同一平面上 | |
| B. | 分子中至少有9个碳原子处于同一平面上 | |
| C. | 该烃苯环上的一氯取代物最多有四种 | |
| D. | 该烃是苯的同系物 |
6.等物质的量的Na、Mg、Al分别与等物质的量的盐酸(1mol)反应生成H2,产生H2体积大小(相同状况)可出现下列四种情况:①Na>Mg=Al ②Na=Mg=Al ③Na<Mg=Al ④Na<Mg<Al,下列判断正确的是( )
| A. | 当n(Na)=n(Mg)=n(Al)=1mol时,①成立 | B. | 当n(Na)=n(Mg)=n(Al)=0.8mol时,②成立 | ||
| C. | 当n(Na)=n(Mg)=n(Al)=0.6mol时,③成立 | D. | 当n(Na)=n(Mg)=n(Al)=0.5mol时,④成立 |
13.能证明丙烯分子里含有一个碳碳双键的事实是( )
| A. | 丙烯分子里碳氢原子个数比为1:2 | |
| B. | 丙烯完全燃烧生成的CO2和H2O的物质的量相等 | |
| C. | 丙烯容易与溴水发生加成反应,且1mol乙烯完全加成消耗1mol溴单质 | |
| D. | 丙烯能使酸性KMnO4溶液褪色 |
10.通常海水的pH=8.1,在稳定海水pH中起作用的离子是( )
| A. | Na+ | B. | HCO3- | C. | CO32- | D. | Cl- |
11.下列说法正确的是( )
| A. | 石油裂化的主要目的是为了提高轻质油的质量和产量 | |
| B. | 石油分馏所得到的馏分是一种具有固定熔沸点的纯净物 | |
| C. | 可燃冰、干冰和冰的主要化学成分相同 | |
| D. | 石油的裂化、分馏、裂解等都是化学变化 |

 ,写出正确的合成路线:
,写出正确的合成路线: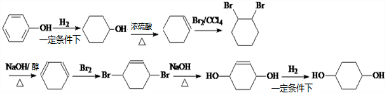 .
.