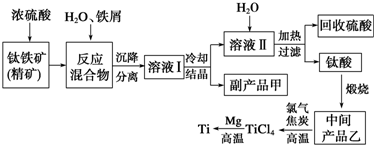
题目内容
17.居室装修用石材的放射性${\;}_{88}^{226}$Ra常用作为标准,居里夫人(Marie Curie)因对Ra元素的研究两度获得诺贝尔奖.下列叙述中正确的是( )| A. | 一个${\;}_{88}^{226}$Ra原子中含有138个中子 | |
| B. | Ra元素位于元素周期表中第六周期ⅡA族 | |
| C. | Ra不能和冷水反应置换氢气 | |
| D. | Ra(OH)2是一种两性氢氧化物 |
分析 A、质子数+中子数=质量数;
B、Ra(镭)位于第ⅡA族,与Ca同主族,Ra元素位于元素周期表第七周期ⅡA族;
C、Ra(镭)位于第ⅡA族,与Ca同主族,镭属于金属元素,金属性比钙强;
D、镭单质比Ca金属性强,则氢氧化物为强碱.
解答 解:A、一个Ra原子中含有226-88=138个中子,故A正确;
B、Ra(镭)位于第ⅡA族,与Ca同主族,Ra元素位于元素周期表第七周期ⅡA族,故B错误;
C、Ra(镭)位于第ⅡA族,与Ca同主族,金属性比钙强,所以能和冷水反应置换氢气,故C错误;
D、镭单质比Ca金属性强,氢氧化钙是强碱,则氢氧化物为强碱,故D错误.
故选:A
点评 本题考查元素的位置及性质,明确Ra与Ca同主族是解答本题的关键,注意性质的相似性和递变性即可解答,题目难度不大.

练习册系列答案
相关题目
7.下列微粒间的作用力中,不属于化学键的是( )
| A. | 分子间作用力 | B. | 金属键 | C. | 共价键 | D. | 离子键 |
5.已知X元素的某种同位素的氯化物XCln为离子化合物,在该化合物中X元素的微粒的核内中子数为m,核外电子数为y,则该同位素的符号是( )
| A. | ${\;}_{y}^{m}$X | B. | ${\;}_{y}^{y+m}$X | C. | ${\;}_{y+n}^{m+y+n}$X | D. | ${\;}_{y+n}^{y+m-n}$X |
12.下列各组有机物,无论以何种比例混合,只要二者的物质的量之和不变,那么完全燃烧时所消耗的氧气的物质的量相等,且所生成的水的物质的量也相等的是( )
| A. | 甲烷和甲酸甲酯 | B. | 乙烷和乙醇 | C. | 苯和苯酚 | D. | 乙炔和苯 |
2.Na2O2、CaC2、CaH2、Mg3N2都能与水反应,且反应中均有气体放出.下列说法正确的是( )
| A. | 都属于氧化还原反应 | |
| B. | 等物质的量的上述物质产生气体体积(相同状况)的大小关系是:Na2O2=CaC2<CaH2=Mg3N2 | |
| C. | Na2O2、CaH2与水反应时水作氧化剂 | |
| D. | CaH2与水反应时产生H2,它既是氧化产物和又是还原产物 |
9.能正确表示下列化学反应的离子方程式是( )
| A. | 足量CO2与NaOH溶液反应:CO2+2OH-=CO32-+H2O | |
| B. | NaHCO3溶液中加入过量Ba(OH)2溶液:2HCO3-+2OH-+Ba2+=BaCO3↓+CO32-+2H2O | |
| C. | 氯化铝溶液中加入足量的氨水:Al3++3OH-=Al(OH)3↓ | |
| D. | 氯化亚铁溶液中加入硝酸:3Fe2++4H++NO3-=3Fe3++2H2O+NO↑ |
7.铜、铬都是用途广泛的金属.工业上利用电镀污泥(主要含有Fe2O3、CuO、Cr2O3及部分难溶杂质)回收金属铜和铬的流程如图甲,已知:部分物质沉淀的pH如表:

CaSO4的溶解度曲线如图乙,请回答下列问题:
(1)滤液I中所含溶质主要有Fe2(SO4)3、Cr2(SO4)3、CuSO4(填化学式).
(2)第②步操作中,先加人Ca(OH)2调节溶液的pH,调节范围为3.2≤pH<4.3,然后将浊液加热至80℃趁热过滤,所得滤渣Ⅱ的成分为Fe(OH)3、CaSO4.
(3)第③步操作中,发现除了生成砖红色沉淀外,还产生了无色刺激性气味的气体.写出该步骤中发生反应的离子方程式2H2O+HSO3-+2Cu2+=Cu2O↓+SO42-+5H+、HSO3-+H+=SO2↑+H2O
(4)当离子浓度≤1×10-5mol•L-1l时,可以认为离子沉淀完全.第④步操作中,若要使Cr3+完全沉淀,则室温下溶液中a的最小值为5.6.(已知Kap[Cr(OH)3]=6.3×10-31,$\root{3}{63}$≈4.0;lg4=0.6)
(5)Cr(OH)3受热分解为Cr2O3,用铝热法可以冶炼金属铬.写出铝热法炼铬的化学方程式Cr2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Cr.
| Fe3+ | Cu2+ | Cr3+ | |
| 开始沉淀pH | 2.1 | 4.7 | 4.3 |
| 完全沉淀pH | 3.2 | 6.7 | a |

CaSO4的溶解度曲线如图乙,请回答下列问题:
(1)滤液I中所含溶质主要有Fe2(SO4)3、Cr2(SO4)3、CuSO4(填化学式).
(2)第②步操作中,先加人Ca(OH)2调节溶液的pH,调节范围为3.2≤pH<4.3,然后将浊液加热至80℃趁热过滤,所得滤渣Ⅱ的成分为Fe(OH)3、CaSO4.
(3)第③步操作中,发现除了生成砖红色沉淀外,还产生了无色刺激性气味的气体.写出该步骤中发生反应的离子方程式2H2O+HSO3-+2Cu2+=Cu2O↓+SO42-+5H+、HSO3-+H+=SO2↑+H2O
(4)当离子浓度≤1×10-5mol•L-1l时,可以认为离子沉淀完全.第④步操作中,若要使Cr3+完全沉淀,则室温下溶液中a的最小值为5.6.(已知Kap[Cr(OH)3]=6.3×10-31,$\root{3}{63}$≈4.0;lg4=0.6)
(5)Cr(OH)3受热分解为Cr2O3,用铝热法可以冶炼金属铬.写出铝热法炼铬的化学方程式Cr2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Cr.
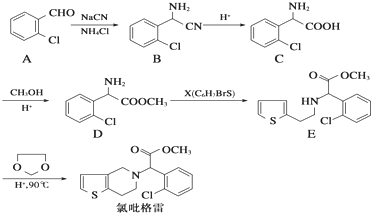 ,
, .
.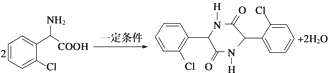 .
.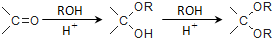 ,则由乙醇、甲醇为有机原料制备化合物
,则由乙醇、甲醇为有机原料制备化合物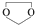 ,需要经历的反应类型有①②③④(填写编号).①加成反应 ②消去反应 ③取代反应 ④氧化反应 ⑤还原反应,写出制备化合物
,需要经历的反应类型有①②③④(填写编号).①加成反应 ②消去反应 ③取代反应 ④氧化反应 ⑤还原反应,写出制备化合物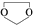 的最后一步反应
的最后一步反应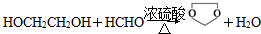 .
.