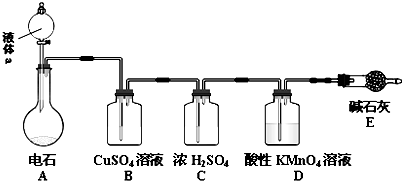
题目内容
2.Na2O2、CaC2、CaH2、Mg3N2都能与水反应,且反应中均有气体放出.下列说法正确的是( )| A. | 都属于氧化还原反应 | |
| B. | 等物质的量的上述物质产生气体体积(相同状况)的大小关系是:Na2O2=CaC2<CaH2=Mg3N2 | |
| C. | Na2O2、CaH2与水反应时水作氧化剂 | |
| D. | CaH2与水反应时产生H2,它既是氧化产物和又是还原产物 |
分析 发生2Na2O2+2H2O=4NaOH+O2↑、CaH2+H2O=Ca(OH)2+H2↑、Mg3N2+6H2O═3Mg(OH)2+2NH3↑、CaC2+2H2O═Ca(OH)2+C2H2↑,结合元素的化合价判断,含元素化合价变化的反应为氧化还原反应,以此来解答.
解答 解:A.CaC2、Mg3N2与水反应生成C2H2和NH3,为水解反应,元素化合价没有发生变化,不属于氧化还原反应,故A错误;
B.设均为1mol,由原子守恒可知,1molNa2O2反应生成0.5molO2,1molCaC2反应生成1molC2H2,1molCaH2反应生成1molH2,1molMg3N2反应生成2molNH3,则生成气体的关系为Na2O2<CaC2<CaH2<Mg3N2,故B错误;
C.Na2O2自身发生氧化还原反应,水既不是氧化剂也不是还原剂,而CaH2+H2O=Ca(OH)2+H2↑中水为氧化剂,故C错误;
D.CaH2与水发生氧化还原反应,方程式为CaH2+H2O=Ca(OH)2+H2↑,反应中H2既是氧化产物又是还原产物,故D正确;
故选D.
点评 本题考查氧化还原反应,为高频考点,侧重于学生的分析能力的考查,注意把握常见水解反应的特点,根据相关反应的方程式进行判断,题目难度不大.

练习册系列答案
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案
相关题目
12.食醋是日常饮食中的一种调味剂,它对改善食物的口感,增进食欲,促进食物消化有独特的功能,因而深受人们青睐.国家标准规定,酿造的食醋中的醋酸含量不得低于3.5g/100mL.某校兴趣小组的同学到超市购买了
某品牌食醋,在实验室中进行食醋中醋酸含量的定量测定实验.
实验原理:用已知浓度的氢氧化钠溶液和醋酸反应.
(1)因食醋有颜色,可能干扰中和滴定时对指示剂颜色的观察,所以须先脱色,但又不能影响醋酸含量的测定,下列所加脱色剂适宜的是C
(填序号). A、氯水 B、Na2O2C、活性炭 D、SO2
(2)用酸式(填“酸式”或“碱式”)滴定管取步骤(1)所得的食醋20.00mL,加入到一洁净的锥形瓶中,并滴加2滴酚酞作指示剂.
(3)用0.5000mol•L-1氢氧化钠溶液进行滴定,并重复滴定操作两次.某同学的实验数据记录如下表:
(4)在实验步骤(2)中,加适量水稀释食醋,对实验结果有无影响?
无影响(填“有影响”或“无影响”),为什么?稀释过程中溶质物质的量不变,消耗的NaOH物质的量不变.
(5)老师在审核了这一表格后指出,所记录的数据有一明显失误,此失误是滴定管的读数在小数点后没有保留两位.实验操作中也存在着失误,在计算时应舍去这一组数据,这一组是第二次滴定的数据.
(6)请以表格中的数据通过计算后说明该食醋是否符合国家标准?不符合(填“符合”或“不符合”).
某品牌食醋,在实验室中进行食醋中醋酸含量的定量测定实验.
实验原理:用已知浓度的氢氧化钠溶液和醋酸反应.
(1)因食醋有颜色,可能干扰中和滴定时对指示剂颜色的观察,所以须先脱色,但又不能影响醋酸含量的测定,下列所加脱色剂适宜的是C
(填序号). A、氯水 B、Na2O2C、活性炭 D、SO2
(2)用酸式(填“酸式”或“碱式”)滴定管取步骤(1)所得的食醋20.00mL,加入到一洁净的锥形瓶中,并滴加2滴酚酞作指示剂.
(3)用0.5000mol•L-1氢氧化钠溶液进行滴定,并重复滴定操作两次.某同学的实验数据记录如下表:
| 食醋的体积/mL | 所用氢氧化钠溶液的体积/mL | |
| 第一次 | 20.00 | 19.8 |
| 第二次 | 20.00 | 21.2 |
| 第三次 | 20.00 | 19.7 |
无影响(填“有影响”或“无影响”),为什么?稀释过程中溶质物质的量不变,消耗的NaOH物质的量不变.
(5)老师在审核了这一表格后指出,所记录的数据有一明显失误,此失误是滴定管的读数在小数点后没有保留两位.实验操作中也存在着失误,在计算时应舍去这一组数据,这一组是第二次滴定的数据.
(6)请以表格中的数据通过计算后说明该食醋是否符合国家标准?不符合(填“符合”或“不符合”).
17.居室装修用石材的放射性${\;}_{88}^{226}$Ra常用作为标准,居里夫人(Marie Curie)因对Ra元素的研究两度获得诺贝尔奖.下列叙述中正确的是( )
| A. | 一个${\;}_{88}^{226}$Ra原子中含有138个中子 | |
| B. | Ra元素位于元素周期表中第六周期ⅡA族 | |
| C. | Ra不能和冷水反应置换氢气 | |
| D. | Ra(OH)2是一种两性氢氧化物 |
7.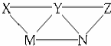 KHSO4、BaCl2、Na2CO3、FeSO4和氯水五种溶液,有如图所示的相互反应,图中每条连线两端的物质可以发生化学反应.下列说法不合理的是( )
KHSO4、BaCl2、Na2CO3、FeSO4和氯水五种溶液,有如图所示的相互反应,图中每条连线两端的物质可以发生化学反应.下列说法不合理的是( )
 KHSO4、BaCl2、Na2CO3、FeSO4和氯水五种溶液,有如图所示的相互反应,图中每条连线两端的物质可以发生化学反应.下列说法不合理的是( )
KHSO4、BaCl2、Na2CO3、FeSO4和氯水五种溶液,有如图所示的相互反应,图中每条连线两端的物质可以发生化学反应.下列说法不合理的是( )| A. | X可能为KHSO4 | B. | M不可能是BaCl2 | C. | Y一定为Na2CO3 | D. | N可能是FeSO4 |
14.两种气态烃的混合物共0.1mol,完全燃烧后生成3.58L(标准状况)二氧化碳和3.6克水,下列说法正确的是( )
| A. | 一定含有乙烯 | B. | 一定含有甲烷和乙烯 | ||
| C. | 一定含有甲烷 | D. | 无法确定 |
11.在一定温度下,将6mol CO2和8mol H2充入2L恒容密闭容器中,发生如下反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<O
分别在t时测得在该容器内n(H2)的数值如下:
则下列说法正确的是( )
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<O
分别在t时测得在该容器内n(H2)的数值如下:
| t/min | 1 | 4 | 8 | 11 |
| n(H2)/mol | 6 | 2.6 | 2 | 2 |
| A. | 该温度下,平衡常数K=0.5 | |
| B. | 反应进行4min时,V(C02)=0.45 mol/(L•min) | |
| C. | 反应进行到9min时,H2的转化率比8min时高 | |
| D. | 反应进行11min后,若增大容器内压强,CO2的转化率一定增大 |
12.下列有关物质的表达式不正确的是( )
| A. | 醛基的结构简式:-CHO | B. | 溴乙烷的电子式: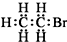 | ||
| C. | 乙炔分子的结构式:H-C≡C-H | D. | 乙醇的分子式:C2H6O |