8.据报道,某些花岗岩会产生具有放射性的氡(${\;}_{86}^{222}$Rn),从而对人体造成伤害,该核素核内中子数与质子数之差为( )
| A. | 86 | B. | 136 | C. | 50 | D. | 222 |
6.下列溶液:①石灰水,②H2S溶液,③KMnO4溶液,④氯水,⑤品红溶液.能够区别SO2和CO2气体的是( )
| A. | ①②③ | B. | 只有②③④ | C. | ②③④⑤ | D. | 全部都行 |
5.卤素是最活泼的一族非金属元素,下列关于卤族元素的说法正确的是( )
| A. | 卤素单质的最外层电子数都是7 | |
| B. | 从上到下,卤素原子的电子层数依次增多,半径依次减小 | |
| C. | 卤素单质与H2化合的容易程度为F2<Cl2<Br2<I2 | |
| D. | 从F到I,原子核对最外层电子的吸引能力依次减弱,原子得电子能力依次减弱,元素的非金属性依次减弱 |
3.A、B、C、D是元素周期表中前四周中五种常见元素,原子序数依次增大.其相关信息如下表:
请回答下列问题:
(1)B在元素周期表中位置第二周期VA族;E2+的核外电子排布式是1s22s22p63s23p63d6.
(2)A,B,C的第一电离能由大到小的顺序为N>O>C;A,B,C的氢氧化物稳定性由大到小的顺序为(填写化学式,下同)H2O>NH3>CH4;B,C,D氢化物的沸点最高的为H2O.
(3)1molAD2分子中含有的π键数目为2NA;该化合物的晶体类型是分子晶体.
(4)生活中E单质在NaCl溶液中发生腐蚀时的正极反应式为O2+2H2O+4e-=4OH-.
| 元素 | 相关信息 |
| A | 原子核外L层电子数是K层的2倍 |
| C | 有两种同素异形体,其中一种可吸附对人体有害的短波紫外线,防止其到达地球表面 |
| D | 价电子排布为(n+1)s+(n+1)p(n+2) |
| E | 苯酚遇其某种价态的离子显紫色 |
(1)B在元素周期表中位置第二周期VA族;E2+的核外电子排布式是1s22s22p63s23p63d6.
(2)A,B,C的第一电离能由大到小的顺序为N>O>C;A,B,C的氢氧化物稳定性由大到小的顺序为(填写化学式,下同)H2O>NH3>CH4;B,C,D氢化物的沸点最高的为H2O.
(3)1molAD2分子中含有的π键数目为2NA;该化合物的晶体类型是分子晶体.
(4)生活中E单质在NaCl溶液中发生腐蚀时的正极反应式为O2+2H2O+4e-=4OH-.
2.为了有效的控制CO2的排放,工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1molCO2和3molH2,在500℃下发生反应:CO2(g)+3H2(g)$\frac{\underline{\;\;\;\;\;催化剂\;\;\;\;\;}}{加热,加压}$CH3OH(g);△H<0.进行试验时所得实验图象如下则下列描述错误的是( )
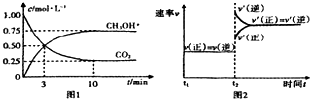

| A. | 平衡时该反应的平衡常数=$\frac{16}{3}(mol/L)^{-2}$ | |
| B. | 平衡时CO2的转化率为50% | |
| C. | t2时刻改变的条件是高温度 | |
| D. | 在0-3min时H2的反应速率为0.5mol•(L•min)-1 |
1. 今年两会的一个主题是环境保护,治理雾霾天气是我们目前最主要的一个任务.如图是北京统计的雾霾天气的来源和成分分析:下列对于治理雾霾天气措施描述不正确的是( )
今年两会的一个主题是环境保护,治理雾霾天气是我们目前最主要的一个任务.如图是北京统计的雾霾天气的来源和成分分析:下列对于治理雾霾天气措施描述不正确的是( )
 今年两会的一个主题是环境保护,治理雾霾天气是我们目前最主要的一个任务.如图是北京统计的雾霾天气的来源和成分分析:下列对于治理雾霾天气措施描述不正确的是( )
今年两会的一个主题是环境保护,治理雾霾天气是我们目前最主要的一个任务.如图是北京统计的雾霾天气的来源和成分分析:下列对于治理雾霾天气措施描述不正确的是( )| A. | 充分的洗涤燃煤,除去燃煤表面的灰尘 | |
| B. | 加快我国由“燃煤”时代进入到“油气”时代的步伐 | |
| C. | 采用催化转换技术将汽车尾气中的NO2和CO转化为无毒气体 | |
| D. | 处理NO2的一种方法是利用甲烷催化还原NO2,若CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H=-512kJ•mol-1,则1g甲烷处理NO2需要放出16kJ的热量 |
20.对复杂的有机物结构可用“键线式”表示.如苯丙烯酸丙烯酯: 可简化为:
可简化为: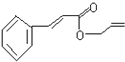 杀虫剂“阿乐丹”的结构表示为:
杀虫剂“阿乐丹”的结构表示为: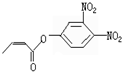 ,它在稀酸作用下能发生水解反应生成两种有机物.下列关于这两种有机物的共同性质叙述不正确的是( )
,它在稀酸作用下能发生水解反应生成两种有机物.下列关于这两种有机物的共同性质叙述不正确的是( )
 可简化为:
可简化为: 杀虫剂“阿乐丹”的结构表示为:
杀虫剂“阿乐丹”的结构表示为: ,它在稀酸作用下能发生水解反应生成两种有机物.下列关于这两种有机物的共同性质叙述不正确的是( )
,它在稀酸作用下能发生水解反应生成两种有机物.下列关于这两种有机物的共同性质叙述不正确的是( )| A. | 遇FeCl3溶液均显紫色 | B. | 均能发生氧化反应 | ||
| C. | 均能与溴水发生反应 | D. | 均能与NaOH溶液发生反应 |
19.按要求回答下列问题:
(1)常温下向一定体积的0.1mol/L醋酸溶液中加水稀释后,下列说法正确的是C.
A.溶液中导电粒子的数目减少
B醋酸的电离程度增大,c(H+)亦增大
C. 溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$不变
D溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c({H}^{+})}$减小
(2)常温下若溶液由pH=3的HA溶液V1mL与pH=11的NaOH溶液V2mL混合而得,则下列正确的是AD.
A.若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7mol/L
B.若V1=V2,反应后溶液pH一定等于7
C.若反应后溶液呈酸性,则V1一定大于V2
D.若反应后溶液呈碱性,则V1一定小于V2
(3)几种离子开始沉淀时的pH如下表:
当向含相同浓度Cu2+、Mg2-、Fe2+离子的溶液中滴加NaOH溶液时,Cu2+(填离子符号)先沉淀,Ksp[Fe(OH)2]<Ksp[(Mg(OH)2](填“>”、“二”或“<”).
0 166938 166946 166952 166956 166962 166964 166968 166974 166976 166982 166988 166992 166994 166998 167004 167006 167012 167016 167018 167022 167024 167028 167030 167032 167033 167034 167036 167037 167038 167040 167042 167046 167048 167052 167054 167058 167064 167066 167072 167076 167078 167082 167088 167094 167096 167102 167106 167108 167114 167118 167124 167132 203614
(1)常温下向一定体积的0.1mol/L醋酸溶液中加水稀释后,下列说法正确的是C.
A.溶液中导电粒子的数目减少
B醋酸的电离程度增大,c(H+)亦增大
C. 溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$不变
D溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c({H}^{+})}$减小
(2)常温下若溶液由pH=3的HA溶液V1mL与pH=11的NaOH溶液V2mL混合而得,则下列正确的是AD.
A.若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7mol/L
B.若V1=V2,反应后溶液pH一定等于7
C.若反应后溶液呈酸性,则V1一定大于V2
D.若反应后溶液呈碱性,则V1一定小于V2
(3)几种离子开始沉淀时的pH如下表:
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
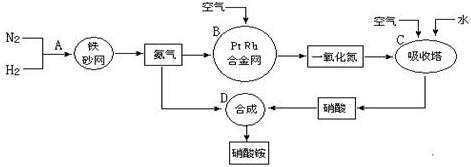
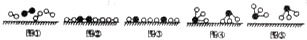
 分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是N2、H2被吸附在催化剂表面、在催化剂表面N2、H2中的化学键断裂.
分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是N2、H2被吸附在催化剂表面、在催化剂表面N2、H2中的化学键断裂.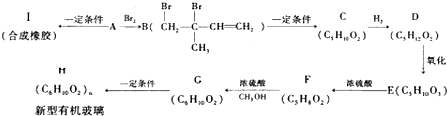
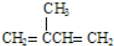 (不考虑立体异构),由G生成H的反应类型是加聚反应;
(不考虑立体异构),由G生成H的反应类型是加聚反应;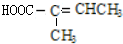 +CH3OH$→_{△}^{浓硫酸}$
+CH3OH$→_{△}^{浓硫酸}$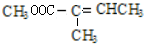 +H2O.与F具有相同官能团且比F少一个碳原子的有机物的同分异构体有3种(不考虑立体异构);
+H2O.与F具有相同官能团且比F少一个碳原子的有机物的同分异构体有3种(不考虑立体异构);