17.下表是25℃时某些盐的浓度积常数和弱酸的电离平衡常数,下列说法正确的是( )
| 化学式 | AgCl | Ag2CrO4 | CH3COOH | HClO | H2CO3 |
| Ks或Ka | Ksp=1.8×10-10 | Ksp=2.0×10-12 | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
| A. | 相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 向0.1mol•L-1CH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=5:9,此时溶液pH=5 | |
| C. | 碳酸钠溶液中滴加少量氯水的离子方程式为CO2-3 +Cl2+H2O=HCO-3+Cl-+HClO | |
| D. | 向浓度均为1×10-3mol•L-1的KCl和K2CrO4混合液中滴加1×10-3mol•L-1的AgNO3溶液,CrO2-4先形成沉淀. |
16.有一无色溶液,仅含有K+、Al3+、Mg2+、NH4+、Cl-、SO42-、HCO3-、MnO4-中的几种.为确定其成分,做如下实验:①取部分溶液,加入适量Na2O2固体,产生无色无味的气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,无沉淀产生.下列推断正确的是( )
| A. | 肯定有Al3+、Mg2+、Cl-,可能有NH4+ | |
| B. | 肯定有Al3+、Mg2+、HCO3-,肯定没有MnO4- | |
| C. | 肯定有K+、Al3+、MnO4-,可能有HCO3- | |
| D. | 肯定有Al3+、Mg2+、Cl-,可能有K+ |
15.下列方法或操作正确且能达到预期目的是( )
| 序号 | 实验目的 | 方法及操作 |
| ① | 比较水和乙醇中羟基氢的活泼性强弱 | 用金属钠分别与水和乙醇反应 |
| ② | 欲证明CH2=CHCHO中含有碳碳双键 | 滴入KMnO4酸性溶液,看紫红色是否褪去 |
| ③ | 证明蛋白质在某些无机盐溶液作用下发生变性 | 向鸡蛋清溶液中加入饱和硫酸铜溶液,有沉淀析出;再把沉淀加入蒸馏水中 |
| ④ | 检验溴乙烷中的溴元素 | 将少量溴乙烷与NaOH溶液混合共热,充分反应并冷却后,向溶液中加稀HNO3酸化,再滴加AgNO3溶液 |
| ⑤ | 判断不同反应的反应速率的大小 | 比较不同反应的反应热数据的大小 |
| A. | ①③④ | B. | ②③④ | C. | ①②④ | D. | ②③⑤ |
13.150℃时,将1L混合烃与9L氧气混合,在密闭容器内充分燃烧,当恢复至150℃,体积恒定时,容器内压强增大8%,则该混合烃的组成是( )
| A. | 甲烷与乙烷体积比是1:4 | B. | 丙炔与乙炔体积比是1:4 | ||
| C. | 乙烯与丁烷体积比是1:4 | D. | 乙烯与丁烯体积比是1:4 |
12.已知某KOH样品中含水7.62%、含 K2CO32.38%、含KOH90%,现将1.00g样品加入46.00mL 1.00 mol/L的盐酸中,过量的酸用1.070mol/L的KOH中和,蒸发溶剂,蒸发到无水时,可得到的固体的质量为( )
| A. | 3.00g | B. | 3.43g | C. | 4.50g | D. | 无法计算 |
11.现有一由Na2SO4、Na2SO3、Na2S组成的混和物,经测定硫的质量分数为2 5.6%,则此混合物中氧元素的质量分数应为( )
| A. | 37.6% | B. | 36.8% | C. | 25.6% | D. | 51.2% |
10.温度为25℃时,将两个铂电极插入一定量的硫酸钠饱和溶液中进行电解,通电一段时间后,在阴极逸出a mol气体,同时有 WgNa2SO4•10H2O析出,若温度不变,此时剩余溶液中的溶质的质量分数为( )
| A. | $\frac{W}{W+18a}$×100% | B. | $\frac{W}{W+36a}$×100% | ||
| C. | $\frac{7100W}{161(W+18a)}$×100% | D. | $\frac{7100W}{161(W+36a)}$×100% |
9.图中横坐标表示完全燃烧时耗用可燃气体X(X=A、B、C)的物质的量n(X),纵坐标表示消耗O2的物质的量n(O2),A、B是两种可燃性气体,C是A、B的混合气体,则C中n(A):n(B) 为( )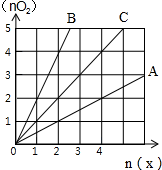
0 166906 166914 166920 166924 166930 166932 166936 166942 166944 166950 166956 166960 166962 166966 166972 166974 166980 166984 166986 166990 166992 166996 166998 167000 167001 167002 167004 167005 167006 167008 167010 167014 167016 167020 167022 167026 167032 167034 167040 167044 167046 167050 167056 167062 167064 167070 167074 167076 167082 167086 167092 167100 203614
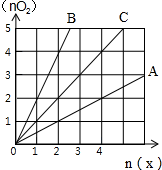
| A. | 2:1 | B. | 1:2 | C. | 1:1 | D. | 任意 |
 (Ⅰ)磷是生物体中不可缺少的元素之一,在自然界中磷总是以磷酸盐的形式出现的,例如磷酸钙矿Ca3(PO4)2、磷灰石Ca5F(PO4)3等.
(Ⅰ)磷是生物体中不可缺少的元素之一,在自然界中磷总是以磷酸盐的形式出现的,例如磷酸钙矿Ca3(PO4)2、磷灰石Ca5F(PO4)3等.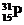 .
.