20.下列说法正确的是( )
| A. | H、N、Na、Fe、V五种元素中,有两种是第四周期元素 | |
| B. | 铁元素位于周期表中的第四周期,第8纵行,属于第ⅧA族 | |
| C. | 第四、五、六、七周期,每周期的元素共有18种 | |
| D. | 碱金属元素是指第ⅠA族的所有元素 |
19.2014年5月3日,科学家在粒子加速器中,用钙离子轰击放射性元素锫,成功生成117号元素,有关该元素的说法正确的是( )
| A. | 117号元素位于第七周期第ⅦB族 | B. | 117号元素是一种金属元素 | ||
| C. | 117号元素最外层有5个电子 | D. | 117号元素没有正化合价 |
18.某待测溶液(阳离子为Na+)中可能含有SO42-、SO32-、NO3-、Cl-、Br-、CO32-、HCO3-中的一种或多种,进行如图所示的实验,每次实验所加试剂均过量,下列说法不正确的是( )


| A. | SO42-、SO32-至少含有一种 | |
| B. | 沉淀B的化学式为BaCO3 | |
| C. | 肯定存在的阴离子有CO32-、HCO3-、Cl-,还有SO42-、SO32-至少含有一种 | |
| D. | 肯定没有的离子是Br- |
15.下列热化学方程式中△H代表燃烧热的是( )
| A. | C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l)△H1 | B. | S(s)+3/2O2(g)=SO3(s)△H2 | ||
| C. | CH4(g)+2O2(g)=2H2O(l)+CO(g)△H3 | D. | 2CO(g)+O2(g)=CO2(g)△H4 |
14.室温时,将盛有NH4HCO3烧杯放入盛有少量醋酸的大烧杯中.然后向小烧杯中加入盐酸溶液,反应剧烈,大烧杯中的醋酸逐渐凝固(乙酸的熔点:16.6℃),下列说法正确的是( )
| A. | NH4HCO3和盐酸的反应是放热反应 | |
| B. | 该反应中,热能转化为化学能 | |
| C. | 反应物的总能量高于生成物的总能量 | |
| D. | 反应的热化学方程式为:NH4HCO3+HCl=NH4Cl+CO2↑+H2O△H>0 |
13.下列说法正确的是( )
0 166882 166890 166896 166900 166906 166908 166912 166918 166920 166926 166932 166936 166938 166942 166948 166950 166956 166960 166962 166966 166968 166972 166974 166976 166977 166978 166980 166981 166982 166984 166986 166990 166992 166996 166998 167002 167008 167010 167016 167020 167022 167026 167032 167038 167040 167046 167050 167052 167058 167062 167068 167076 203614
| A. | 所有的化学反应都有能量变化 | |
| B. | 只要有能量的变化,一定发生了化学反应 | |
| C. | 据能量守恒定律,反应物的总能量一定等于生成物的总能量 | |
| D. | 需要加热才能发生的反应一定是吸热反应 |
 针对化学反应中的能量变化解决下列问题.
针对化学反应中的能量变化解决下列问题.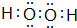 .
.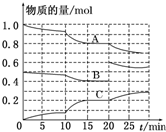 在恒定温度T℃,2L恒容密闭容器中发生反应aA(g)+bB(g)?cC(g),容器中A、B、C物质的量变化如图所示,回答下列问题:
在恒定温度T℃,2L恒容密闭容器中发生反应aA(g)+bB(g)?cC(g),容器中A、B、C物质的量变化如图所示,回答下列问题: 钠的化合物在生产生活中应用广泛.
钠的化合物在生产生活中应用广泛.