题目内容
17. 针对化学反应中的能量变化解决下列问题.
针对化学反应中的能量变化解决下列问题.(1)测定稀硫酸和稀氢氧化钠中和热(中和热为57.3kJ•mol-1)的实验装置如图1所示.某兴趣小组的实验数值结果小于57.3kJ•mol-1,原因可能是acd (填字母).
a.实验装置保温、隔热效果差
b.读取混合液的最高温度记为终点温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后未洗涤,直接测定H2SO4溶液的温度2
(2)今有如下两个热化学方程式:则a>b(填“>”、“=”或“<”).
H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H1=a kJ•mol-1?
H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H2=b kJ•mol-1?
(3)同素异形体相互转化的反应热相当小而且转化速率较慢,有时还很不完全,测定反应热很困难.现在可根据盖斯提出的“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的”观点来计算反应热.已知:
P4(白磷,s)+5O2(g)=P4O10(s)△H=-2983.2kJ•mol-1 ①
P(红磷,s)+5/4O2(g)=1/4P4O10(s)△H=-738.5kJ•mol-1 ②
则白磷转化为红磷的热化学方程式为P4(白磷,s)═4P(红磷,s)△H=-29.2kJ•mol-1.相同状况下,能量状态较低的是红磷;白磷的稳定性比红磷低(填“高”或“低”).
(4)用Cl2生产某些含氯有机物时会产生副产物HCl.利用反应A,可实现氯的循环利用.
反应A:4HCl+O2$?_{400℃}^{CuO/CuCl_{2}}$2Cl2+2H2O
已知:Ⅰ.此条件下反应A中,4molHCl被氧化,放出115.6kJ的热量.
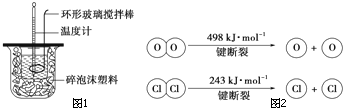
Ⅱ.①写出此条件下,反应A的热化学方程式4HCl(g)+O2(g)?2Cl2(g)+2H2O(g)△H=-115.6kJ•mol-1.
②见图2,断开1molH-O键与断开1mol H-Cl键所需能量相差约为31.9kJ,H2O中H-O键比HCl中HCl键(填“强”或“弱”)强.
分析 (1)a.装置保温、隔热效果差,会损失热量,测得的热量偏小;
b.反应后最高温度记为终点温度;
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中,会损失热量,测得的热量偏小;
d.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,硫酸的起始温度偏高.
(2)两个热化学方程式的区别在于物质的聚集状态不同,固体→液体→气体的过程为吸热过程,反之为放热过程;
(3)利用盖斯定律可以解答;物质的能量越低,越稳定;
(3)①反应A中,4mol HCl被氧化,放出115.6kJ的热量,依据热化学方程式书写方法,标注物质聚集状态和对应焓变写出热化学方程式;
②依据反应A中,4mol HCl被氧化,放出115.6kJ的热量,焓变=反应物断键吸收热量-生成物形成化学键放出热量计算;键能越大,越稳定;
解答 解:(1)a.装置保温、隔热效果差,会损失热量,测得的热量偏小,中和热的数值偏小,故a正确;
b.反应后最高温度记为终点温度,故b错误;
c.尽量一次快速将NaOH溶液倒入盛有硫酸的小烧杯中,不允许分多次把NaOH溶液倒入盛有硫酸的小烧杯中,否则会引起热量散失,中和热的数值偏小,故c正确;
d.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,由于温度计上会有氢氧化钠,氢氧化钠与硫酸反应放热,导致硫酸的起始温度偏高,中和热的数值偏小,故d正确.
故答案为:acd;
(2)a与b相比较,由于气体变成液体放热,则b反应放出的热量比a多,由于a,b都是负值,则a>b,故答案为:>;
(3)P4(白磷,s)+5O2(g)=P4O10(s)△H=-2983.2kJ•mol-1 ①
P(红磷,s)+5/4O2(g)=1/4P4O10(s)△H=-738.5kJ•mol-1 ②
据盖斯定律,①-②×4可得:P4(白磷,s)═4P(红磷,s)△H=-29.2kJ•mol-1
从上面的热化学方程式可见,相同状况下,白磷比红磷能量高;因为能量越低越稳定,所以红磷比白磷稳定.
故答案为:P4(白磷,s)═4P(红磷,s)△H=-29.2kJ•mol-1;红磷;低;
(3)①依据反应A中,4molHCl被氧化,放出115.6kJ的热量,反应的热化学方程式为:4HCl(g)+O2(g)?2Cl2(g)+2H2O(g)△H=-115.6kJ•mol-1;
故答案为:4HCl(g)+O2(g)?2Cl2(g)+2H2O(g)△H=-115.6kJ•mol-1;
②焓变△H=反应物断键吸收热量-生成物形成化学键放出热量,由4HCl(g)+O2(g)?2Cl2(g)+2H2O(g)△H=-115.6kJ•mol-1,可得:4×E(H-Cl)+498-[243×2+4×E(H-O)]=-115.6,得到4×E(H-O)-4×E(H-Cl)=498-486+115.6=127.6,E(H-O)-E(H-Cl)=31.9;H2O中H-O键的键能大于比HCl中HCl键的键能,所以H2O中H-O键比HCl中HCl键强;
故答案为:31.9;强;
点评 本题考查了中热热的测定、盖斯定律的运用、物质的稳定性与能量的关系、热化学方程式书写,化学键键能和焓变关系计算,题目难度中等,答题时注意体会.

| A. | 若x=2,达到平衡后B 的体积分数关系为:φ(M)>φ(N) | |
| B. | 若x<2,达到平衡后B的转化率关系为:α(M)>α(N) | |
| C. | 若x>2,C的平衡物质的量浓度关系为:c(M)>c(N) | |
| D. | x不论为何值,起始时向N容器中充入任意值的A,平衡后N容器中B的浓度均相等 |
| A. | C、N、Cl | B. | F、O、H | C. | S、P、Si | D. | Na、Mg、Al |
| A. | 3n | B. | 3n-8 | C. | -3n | D. | 8-3n |
| A. | Fe | B. | Si | C. | Cu | D. | Na |
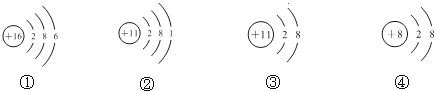
| A. | 它们表示三种元素 | |
| B. | ②③的化学性质相同 | |
| C. | ②表示的元素是金属元素 | |
| D. | ①表示的是原子,而④表示的是阴离子 |
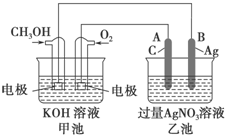 如图是一个化学过程的示意图.已知甲池的总反应式为2CH3OH+3O2+4KOH═2K2CO3+6H2O
如图是一个化学过程的示意图.已知甲池的总反应式为2CH3OH+3O2+4KOH═2K2CO3+6H2O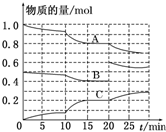 在恒定温度T℃,2L恒容密闭容器中发生反应aA(g)+bB(g)?cC(g),容器中A、B、C物质的量变化如图所示,回答下列问题:
在恒定温度T℃,2L恒容密闭容器中发生反应aA(g)+bB(g)?cC(g),容器中A、B、C物质的量变化如图所示,回答下列问题: