7.下列各组所有的元素组合,既可形成离子化合物,又可形成共价化合物的是( )
| A. | H、C、O、Na | B. | H、K、O、S | C. | H、O、S | D. | H、N、O |
5.如图所示,隔板Ⅰ固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:3A(g)?xB(g)+xC(g)△H=-192kJ•mol-1,向M、N中都通入3mol A 的气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )
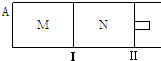

| A. | 若x=2,达到平衡后B 的体积分数关系为:φ(M)>φ(N) | |
| B. | 若x<2,达到平衡后B的转化率关系为:α(M)>α(N) | |
| C. | 若x>2,C的平衡物质的量浓度关系为:c(M)>c(N) | |
| D. | x不论为何值,起始时向N容器中充入任意值的A,平衡后N容器中B的浓度均相等 |
2.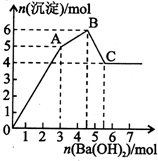 向FeCl3、Al2(SO4)3的混和溶液中逐滴加入Ba(OH)2(aq),形成沉淀的情况如下图所示.沉淀的生成与溶解的pH列于下表(已知:偏铝酸钡易溶于水).以下推断正确的是( )
向FeCl3、Al2(SO4)3的混和溶液中逐滴加入Ba(OH)2(aq),形成沉淀的情况如下图所示.沉淀的生成与溶解的pH列于下表(已知:偏铝酸钡易溶于水).以下推断正确的是( )
 向FeCl3、Al2(SO4)3的混和溶液中逐滴加入Ba(OH)2(aq),形成沉淀的情况如下图所示.沉淀的生成与溶解的pH列于下表(已知:偏铝酸钡易溶于水).以下推断正确的是( )
向FeCl3、Al2(SO4)3的混和溶液中逐滴加入Ba(OH)2(aq),形成沉淀的情况如下图所示.沉淀的生成与溶解的pH列于下表(已知:偏铝酸钡易溶于水).以下推断正确的是( )| 氢氧化物 | 溶液pH | |||
| 开始沉淀 | 沉淀完全 | 沉淀开始溶解 | 沉淀完全溶解 | |
| Fe(OH)3 | 2.3 | 3.4 | ||
| Al(OH)3 | 3.3 | 5.2 | 7.8 | 12.8 |
| A. | 据图计算原溶液中c(Cl-)=c(SO42-) | |
| B. | OA段产生的沉淀为BaSO4和Fe(OH)3 | |
| C. | AB段可能发生的反应是:2SO42-+2Ba2++Al3++30H-=2BaSO4k+Al(OH)3↓ | |
| D. | C点溶液呈碱性的原因是AlO2-水解,其离子方程式为:AlO2-+2H2O=Al(OH)3+OH- |
1.下列说法正确的是( )
| A. | 能使pH试纸呈红色的溶液中可能大量存在以下离子:Na+、NH4+、I-、NO3- | |
| B. | 将CH3COOH溶液和NaOH溶液等体积混合,该溶液中一定存在的关系式为:c(Na+)=c(CH3COO-)+c(CH3COOH) | |
| C. | pH=3的NaHA溶液中粒子浓度大小为:c(Na+)>c(HA-)>c(A2-)>c(H2A)>c(OH-) | |
| D. | CuSO4溶液遇到闪锌矿(ZnS)慢慢转化为铜蓝(CuS),是因为ZnS的溶解度大于CuS |
20.下列有关实验操作设计、现象记录、结论解释都正确的是( )
| 实验操作设计 | 现象记录 | 结论解释 | |
| A | 将少量浓硝酸逐滴加入Cu 和稀硫酸的混合物中 | 产生红棕色气体 | 硝酸被还原为NO2 |
| B | 用坩埚钳夹住铝箔在酒精灯 上加热 | 铝箔熔化但并不滴落 | 熔点:Al2 O3>Al |
| C | 向某氯化亚铁溶液中加入 Na2O2粉末 | 出现红褐色沉淀 | 加入Na2O2粉末前,原氯化 亚铁溶液已经变质 |
| D | 向紫色石蕊试液中持续长时 间通人氯气 | 溶液先变红,最后变 为无色 | 氯气有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
19.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
0 166875 166883 166889 166893 166899 166901 166905 166911 166913 166919 166925 166929 166931 166935 166941 166943 166949 166953 166955 166959 166961 166965 166967 166969 166970 166971 166973 166974 166975 166977 166979 166983 166985 166989 166991 166995 167001 167003 167009 167013 167015 167019 167025 167031 167033 167039 167043 167045 167051 167055 167061 167069 203614
| A. | 1mol C(金刚石)中含有C-C键的数目为4NA | |
| B. | 标准状况下,22.4L乙烯中含有σ键的数目为5NA | |
| C. | 含0.2moi H2SO4的浓硫酸与足量铜充分反应,生成SO2分子的数目为0.1NA | |
| D. | 电解精炼铜时,若阳极质量减少32g,则阴极得到电子的数目为NA |
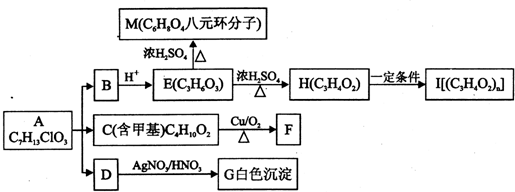
 +O2$→_{△}^{Cu}$
+O2$→_{△}^{Cu}$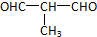 +2H2O.
+2H2O.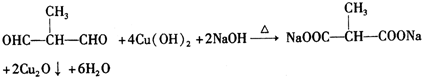 .
.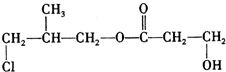
 .
.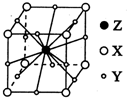 X、Y、Z、W为短周期元素且原子序数依次增大.X的一种气态氢化物m可用来焊接或切割金属,且该分子所有原子在一条直线上.Y2-的M能层的原子轨道为全空状态.Z的单质用作铝热反应的引燃剂. W与X形成的化合物是一种常见的有机溶剂n.A为第四周期元素,其基态原子含有6个未成对电子.
X、Y、Z、W为短周期元素且原子序数依次增大.X的一种气态氢化物m可用来焊接或切割金属,且该分子所有原子在一条直线上.Y2-的M能层的原子轨道为全空状态.Z的单质用作铝热反应的引燃剂. W与X形成的化合物是一种常见的有机溶剂n.A为第四周期元素,其基态原子含有6个未成对电子.