题目内容
19.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )| A. | 1mol C(金刚石)中含有C-C键的数目为4NA | |
| B. | 标准状况下,22.4L乙烯中含有σ键的数目为5NA | |
| C. | 含0.2moi H2SO4的浓硫酸与足量铜充分反应,生成SO2分子的数目为0.1NA | |
| D. | 电解精炼铜时,若阳极质量减少32g,则阴极得到电子的数目为NA |
分析 A.金刚石中,每个C与其它4个C原则形成4个碳碳键,根据均摊法计算出1mol金刚石中含有的碳碳键数目;
B.单键为σ键,双键含有1个σ键和1个π键,三键含有1个σ键和2个π键,1mol乙烯分子中的σ键为5mol;
C.只有浓硫酸才能与铜在加热条件下发生反应,稀硫酸与铜不反应;
D.根据粗铜中含有杂质(铁)的摩尔质量比铜小,转移的电子的物质的量大于1mol分析.
解答 解:A.金刚石中,每个C形成的共价键为:$\frac{1}{2}$×4=2,则1mol金刚石形成的共价键为:1mol×2=2mol,所以1mol金刚石中含有C-C键的数目为2NA,故A错误;
B.乙烯分子中有1个C=C和4个C-H,所以乙烯分子有5σ键和1个π键,标准状况下,22.4L乙烯为1mol,含有σ键的数目为5NA,故B正确;
C.浓硫酸随反应进行浓度变稀后不能和铜在继续反应,硫酸不能全部反应;含0.2mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数小于0.1NA,故C错误;
D.电解精炼铜时,若阳极质量减少32g,由于阳极有铁杂质存在,铁的摩尔质量小于铜的,所以阳极减少32g,转移的电子的物质的量大于1mol,则阴极得到的电子数大于NA,故D错误;
故选B.
点评 本题考查了阿伏伽德罗常数,注意从物质的组成、结构、性质以及存在和条件和聚集状态等角度思考,本题难度不大.

练习册系列答案
相关题目
9.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,18 g H20所含的中子数为10NA | |
| B. | 一定条件下1 mol铁粉与浓硫酸反应,转移电子数一定为3NA | |
| C. | 在1 L的碳酸钠溶液中,若c(CO32一)=1 mol•L-1,则Na+数目大于2NA | |
| D. | 含阴阳离子总数为4NA的固体Na202溶于水配成1 L溶液,所得溶液中Na+的物质的量浓度为2 mol•L-1 |
7.${\;}_{\;}^{37}$Cl、${\;}_{\;}^{35}$Cl为不同的核素,下列说法正确的是( )
| A. | ${\;}_{\;}^{37}$Cl2的摩尔质量是74 | |
| B. | 通常情况下,氯气做氧化剂,但氯气也具有还原性 | |
| C. | 35克的${\;}_{\;}^{35}$Cl2含有电子17mol | |
| D. | 常温下,4.48L ${\;}_{\;}^{37}$Cl2含有8NA 个中子(NA 为阿伏加德罗常数) |
14.X、Y、Z、W、R属于短周期主族元素,X在短周期主族元素中原子半径最大,Y元素的原子最外层电子数为m,次外层电子数为n,Z元素的原子L层电子数为m+n,M层电子数为m-n,W元素与Z元素同主族,R元素原子与Y元素原子的核外电子数之比为2:1.下列叙述正确的是( )
| A. | 原子半径:X>R>Z>Y | |
| B. | 最高价氧化物对应水化物的酸性:R>Z>W | |
| C. | 对应单质的沸点:X>Z>Y | |
| D. | RY2、WY2通入BaCl2溶液中均无白色沉淀生成 |
11.用一种阴、阳离子双隔膜三室电解槽处理废水中的NH4+,模拟装置如图所示,下列说法正确的是( )
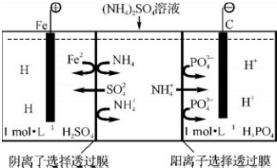

| A. | 阳极室溶液由无色变成棕黄色 | |
| B. | 阴极的电极反应式为:4OH--4e═2H2O+O2↑ | |
| C. | 电解一段时间后,阴极室溶液中的pH升高 | |
| D. | 电解一段时间后,阴极室溶液中的溶质一定是(NH4)3PO4 |
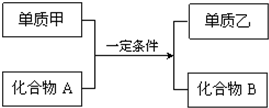 置换反应的通式可表示为:
置换反应的通式可表示为:
 +O2$→_{△}^{Cu}$
+O2$→_{△}^{Cu}$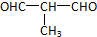 +2H2O.
+2H2O.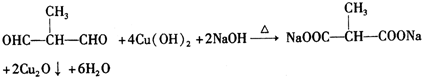 .
.
 .
. 元素周期表中第ⅦA族元素的单质及其化合物的用途广泛.
元素周期表中第ⅦA族元素的单质及其化合物的用途广泛.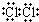 .新制的氯水可用于漂白,工业上将氯气制成漂白粉的目的是漂白粉比次氯酸稳定,便于储存和运输,漂白粉是一种混合物(填“混合物”或“纯净物”)
.新制的氯水可用于漂白,工业上将氯气制成漂白粉的目的是漂白粉比次氯酸稳定,便于储存和运输,漂白粉是一种混合物(填“混合物”或“纯净物”) 钠的化合物在生产生活中应用广泛.
钠的化合物在生产生活中应用广泛.