题目内容
6.写出Fe(NO3)3水解的离子方程式:Fe3++3H2O?Fe(OH)3+3H+.分析 Fe(NO3)3中含有铁离子,铁离子水解生成氢氧化铁和氢离子,由此分析解答.
解答 解:Fe(NO3)3中含有铁离子,铁离子水解生成氢氧化铁和氢离子,水解方程式为Fe3++3H2O?Fe(OH)3+3H+,
故答案为:Fe3++3H2O?Fe(OH)3+3H+.
点评 本题考查了水解原理,难度不大,弱根离子水解导致盐溶液呈酸碱性,注意水解方程式不能写沉淀符号、气体符号,明确水解是微弱的,要写可逆号.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.X、Y、Z、W、R属于短周期主族元素,X在短周期主族元素中原子半径最大,Y元素的原子最外层电子数为m,次外层电子数为n,Z元素的原子L层电子数为m+n,M层电子数为m-n,W元素与Z元素同主族,R元素原子与Y元素原子的核外电子数之比为2:1.下列叙述正确的是( )
| A. | 原子半径:X>R>Z>Y | |
| B. | 最高价氧化物对应水化物的酸性:R>Z>W | |
| C. | 对应单质的沸点:X>Z>Y | |
| D. | RY2、WY2通入BaCl2溶液中均无白色沉淀生成 |
1.下列说法正确的是( )
| A. | 能使pH试纸呈红色的溶液中可能大量存在以下离子:Na+、NH4+、I-、NO3- | |
| B. | 将CH3COOH溶液和NaOH溶液等体积混合,该溶液中一定存在的关系式为:c(Na+)=c(CH3COO-)+c(CH3COOH) | |
| C. | pH=3的NaHA溶液中粒子浓度大小为:c(Na+)>c(HA-)>c(A2-)>c(H2A)>c(OH-) | |
| D. | CuSO4溶液遇到闪锌矿(ZnS)慢慢转化为铜蓝(CuS),是因为ZnS的溶解度大于CuS |
11.用一种阴、阳离子双隔膜三室电解槽处理废水中的NH4+,模拟装置如图所示,下列说法正确的是( )
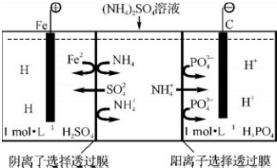

| A. | 阳极室溶液由无色变成棕黄色 | |
| B. | 阴极的电极反应式为:4OH--4e═2H2O+O2↑ | |
| C. | 电解一段时间后,阴极室溶液中的pH升高 | |
| D. | 电解一段时间后,阴极室溶液中的溶质一定是(NH4)3PO4 |
18.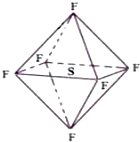 六氟化硫分子呈正八面体形(如图所示),在高电压下仍有良好的绝缘性,在电器工业方面有着广泛的用途,但逸散到空气中会引起温室效应,下列有关六氟化硫的推测正确的是( )
六氟化硫分子呈正八面体形(如图所示),在高电压下仍有良好的绝缘性,在电器工业方面有着广泛的用途,但逸散到空气中会引起温室效应,下列有关六氟化硫的推测正确的是( )
 六氟化硫分子呈正八面体形(如图所示),在高电压下仍有良好的绝缘性,在电器工业方面有着广泛的用途,但逸散到空气中会引起温室效应,下列有关六氟化硫的推测正确的是( )
六氟化硫分子呈正八面体形(如图所示),在高电压下仍有良好的绝缘性,在电器工业方面有着广泛的用途,但逸散到空气中会引起温室效应,下列有关六氟化硫的推测正确的是( )| A. | 六氟化硫易燃烧生成二氧化硫 | |
| B. | 六氟化硫中各原子均达到8电子稳定结构 | |
| C. | 六氟化硫分子中的S-F键都是σ键,且键长、键能都相等 | |
| D. | 六氟化硫分子是极性分子 |
17.某温度下,在容积可变的容器中,反应2A(g)+B(g)═2C(g)达到平衡时,A、B和C的物质的量分别为4mol,2mol和4mol.保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡向左移动的是( )
| A. | 均减半 | B. | 均加半 | C. | 均增加1mol | D. | 均减少1mol |
18.某待测溶液(阳离子为Na+)中可能含有SO42-、SO32-、NO3-、Cl-、Br-、CO32-、HCO3-中的一种或多种,进行如图所示的实验,每次实验所加试剂均过量,下列说法不正确的是( )


| A. | SO42-、SO32-至少含有一种 | |
| B. | 沉淀B的化学式为BaCO3 | |
| C. | 肯定存在的阴离子有CO32-、HCO3-、Cl-,还有SO42-、SO32-至少含有一种 | |
| D. | 肯定没有的离子是Br- |
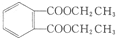 )是一种重要的工业塑化剂,其合成路线很多,如图就是其中的一种合成方法:
)是一种重要的工业塑化剂,其合成路线很多,如图就是其中的一种合成方法: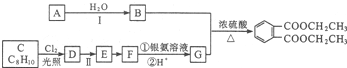
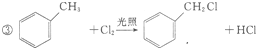
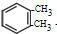 +2Cl2$\stackrel{光照}{→}$
+2Cl2$\stackrel{光照}{→}$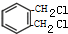 +2HCl.
+2HCl. ;
;