17.在一定温度下,将气体X和气体Y各0.16mol充入10.1,恒容器闭容器中,发生反应X(g)+Y(g)?2Z(g)△H<0,一段时间后达到平衡,反应过程中测定的数据如表:下列说法正确的是( )
| t/min | 2 | 4 | 7 | 9 |
| n(Y)mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A. | 反应前2min的平均速率x(Z)=2.0×10-3mol•L-1min-1 | |
| B. | 其他条件不变,向平衡体系中再充入0.16mol气体X,与原平衡相比,达到新平衡时,气体Y的转化率增大,X的体积分数增大,Z的体积分数减少 | |
| C. | 其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正) | |
| D. | 保持其他条件不变,起始时向溶液中充入0.32mol气体X和0.32mol气体Y,到达平衡时,n(Z)<0.24mol |
16.铬铁矿是主要成分可表示为FeO•Cr2O3,还含有还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的工艺流程.
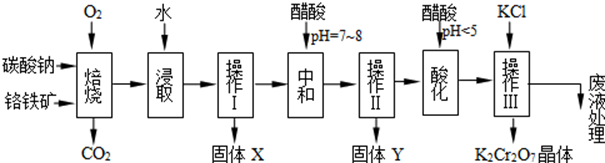
已知1:
①4FeO•Cr2O3+8Na2CO3+7O2 $\stackrel{750℃}{→}$8Na2CrO4+2Fe2O3+8CO2↑;
②Na2CO3+Al2O3 $\stackrel{750℃}{→}$2NaAlO2+CO2↑;
③Cr2O72-+H2O?2CrO42-+2H+
根据题意回答下列问题:
(1)操作I的名称是过滤.
(2)下表是相关物质的溶解度数据,操作Ⅲ发生反应的化学方程式是:Na2Cr207+2KCl=K2Cr207↓+2NaCl,该反应在溶液中能发生的理由是Na2Cr207的溶解度比K2Cr207大
(3)操作Ⅲ有多步组成,获得K2Cr207晶体的操作依次是:加入KC1固体、蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(4)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量的方法是:称取n g样品,加入过量NaOH溶液 (写试剂)、溶解、过滤、再通入足量CO2气体…灼烧、冷却、称量,得干燥固体m g.计算样品中氢氧化铝的质量分数为$\frac{26n}{17m}$ (用含m、n的代数式表示).
(5)称取重铬酸钾试样2.500g配成250mL溶液,取出25mL与碘量瓶中,加入10mL 2mol/L H2SO4和足量碘化钾,放于暗处5min.然后加入100mL水,加入3mL 淀粉指示剂,用0.1000mol/LNa2S203标准溶液滴定,若实验中共用去Na2S203标准溶液47.40mL,则所得产品中重铬酸钾的纯度为92.9%.(保留3位有效数字)
已知:
①K2Cr2O7的摩尔质量为294g/mol
②Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O;
I2+2S2O32-=2I-+S4O62-.

已知1:
①4FeO•Cr2O3+8Na2CO3+7O2 $\stackrel{750℃}{→}$8Na2CrO4+2Fe2O3+8CO2↑;
②Na2CO3+Al2O3 $\stackrel{750℃}{→}$2NaAlO2+CO2↑;
③Cr2O72-+H2O?2CrO42-+2H+
根据题意回答下列问题:
(1)操作I的名称是过滤.
(2)下表是相关物质的溶解度数据,操作Ⅲ发生反应的化学方程式是:Na2Cr207+2KCl=K2Cr207↓+2NaCl,该反应在溶液中能发生的理由是Na2Cr207的溶解度比K2Cr207大
| 物质 | KCl | NaCl | K2Cr2O7 | Na2Cr2O7 | |
| 溶解度(g/100g水) | 0℃ | 28 | 35.7 | 4.7 | 163 |
| 40℃ | 40.1 | 36.4 | 26.3 | 215 | |
| 80℃ | 51.3 | 38 | 73 | 376 | |
(4)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量的方法是:称取n g样品,加入过量NaOH溶液 (写试剂)、溶解、过滤、再通入足量CO2气体…灼烧、冷却、称量,得干燥固体m g.计算样品中氢氧化铝的质量分数为$\frac{26n}{17m}$ (用含m、n的代数式表示).
(5)称取重铬酸钾试样2.500g配成250mL溶液,取出25mL与碘量瓶中,加入10mL 2mol/L H2SO4和足量碘化钾,放于暗处5min.然后加入100mL水,加入3mL 淀粉指示剂,用0.1000mol/LNa2S203标准溶液滴定,若实验中共用去Na2S203标准溶液47.40mL,则所得产品中重铬酸钾的纯度为92.9%.(保留3位有效数字)
已知:
①K2Cr2O7的摩尔质量为294g/mol
②Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O;
I2+2S2O32-=2I-+S4O62-.
15.同类晶体物质熔、沸点的变化是有规律的,试分析下列两组物质熔点规律性变化的原因:
晶体熔、沸点的高低,决定于组成晶体微粒间的作用力的大小.A组是离子晶体,晶体微粒之间通过离子相连.B组晶体属金属键结合而成的金属晶体,价电子数由少到多的顺序是Na<Mg<Al,粒子半径由大到小的顺序是Na+>Mg2+>Al3+.
| 物质 | A | NaCl | KCl | CaCl2 |
| 熔点(K) | 1074 | 918 | ||
| 物质 | B | Na | Mg | Al |
| 熔点(K) | 317 | 923 | 933 |
12. 酸碱中和滴定是中学化学中重要的定量实验之一.
酸碱中和滴定是中学化学中重要的定量实验之一.
Ⅰ.某研究性学习小组准确进行了如下实验,称取1.00g不纯的苛性钠样品配成250ml溶液,取出10.00ml,用已知浓度为0.040mol•L-1的盐酸进行滴定(杂质不与盐酸反应).
根据要求回答下列问题:
(1)配制250mL 0.040mol•L-1的盐酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管和250mL容量瓶.
(2)为测定该苛性钠溶液的准确浓度,几次滴定消耗盐酸的体积如下:
①计算苛性钠浓度时,哪次实验的数据不宜采用?答:3.(填实验序号)
②该苛性钠溶液的浓度为0.080 mol•L-1.
(3)若操作过程中未用盐酸润洗滴定管,对测定结果有怎样的影响?答:偏大(填“偏大”、“偏小”或“无影响”).
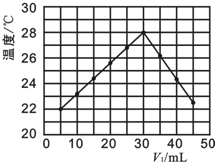
Ⅱ.在另一次实验中,研究性小组将V1 mL 1.0mol•L-1 HCl溶液和V2 mL 未知浓度的NaOH溶液均匀混合后,测量并记录溶液温度,实验结果如右图所示(实验中始终保持V1+V2=50mL).
(4)下列叙述中正确的是B
A.该实验的环境温度为22℃
B.当V1=40时,溶液中c(Na+)<c(Cl-)
C.NaOH溶液的浓度为1.0mol•L-1
D.保持其他条件不变,只将HCl改为CH3COOH
进行实验,也得到如图的实验结果.
0 166848 166856 166862 166866 166872 166874 166878 166884 166886 166892 166898 166902 166904 166908 166914 166916 166922 166926 166928 166932 166934 166938 166940 166942 166943 166944 166946 166947 166948 166950 166952 166956 166958 166962 166964 166968 166974 166976 166982 166986 166988 166992 166998 167004 167006 167012 167016 167018 167024 167028 167034 167042 203614
 酸碱中和滴定是中学化学中重要的定量实验之一.
酸碱中和滴定是中学化学中重要的定量实验之一.Ⅰ.某研究性学习小组准确进行了如下实验,称取1.00g不纯的苛性钠样品配成250ml溶液,取出10.00ml,用已知浓度为0.040mol•L-1的盐酸进行滴定(杂质不与盐酸反应).
根据要求回答下列问题:
(1)配制250mL 0.040mol•L-1的盐酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管和250mL容量瓶.
(2)为测定该苛性钠溶液的准确浓度,几次滴定消耗盐酸的体积如下:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗盐酸溶液的体积(mL) | 20.05 | 20.00 | 22.10 | 19.95 |
②该苛性钠溶液的浓度为0.080 mol•L-1.
(3)若操作过程中未用盐酸润洗滴定管,对测定结果有怎样的影响?答:偏大(填“偏大”、“偏小”或“无影响”).
Ⅱ.在另一次实验中,研究性小组将V1 mL 1.0mol•L-1 HCl溶液和V2 mL 未知浓度的NaOH溶液均匀混合后,测量并记录溶液温度,实验结果如右图所示(实验中始终保持V1+V2=50mL).
(4)下列叙述中正确的是B
A.该实验的环境温度为22℃
B.当V1=40时,溶液中c(Na+)<c(Cl-)
C.NaOH溶液的浓度为1.0mol•L-1
D.保持其他条件不变,只将HCl改为CH3COOH
进行实验,也得到如图的实验结果.


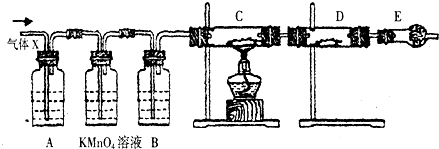
 某研究人员应用如图所表示的方法研究物质的性质,其中气体A的主要成分是氯气,杂质是空气和水蒸气.请完成下列问题:
某研究人员应用如图所表示的方法研究物质的性质,其中气体A的主要成分是氯气,杂质是空气和水蒸气.请完成下列问题: