题目内容
17.在一定温度下,将气体X和气体Y各0.16mol充入10.1,恒容器闭容器中,发生反应X(g)+Y(g)?2Z(g)△H<0,一段时间后达到平衡,反应过程中测定的数据如表:下列说法正确的是( )| t/min | 2 | 4 | 7 | 9 |
| n(Y)mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A. | 反应前2min的平均速率x(Z)=2.0×10-3mol•L-1min-1 | |
| B. | 其他条件不变,向平衡体系中再充入0.16mol气体X,与原平衡相比,达到新平衡时,气体Y的转化率增大,X的体积分数增大,Z的体积分数减少 | |
| C. | 其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正) | |
| D. | 保持其他条件不变,起始时向溶液中充入0.32mol气体X和0.32mol气体Y,到达平衡时,n(Z)<0.24mol |
分析 A.根据v=$\frac{△c}{△t}$进行计算;
B.向平衡体系中再充入0.16mol气体X,平衡正向移动;
C.该反应的正反应是放热反应,降低温度平衡正向移动;
D.保持其他条件不变,起始时向溶液中充入0.32mol气体X和0.32mol气体Y,投料比与原来相等,由于反应前后气体的体积相等,故新平衡与原平衡为等效平衡.
解答 解:A.2min内Y物质的量变化为0.16mol-0.12mol=0.04mol,故生成Z的物质的量为0.08mol,故v(Z)=$\frac{0.08mol}{\frac{10L}{2min}}$=4.0×10-3mol•L-1min-1,故A错误;
B.其他条件不变,向平衡体系中再充入0.16mol气体X,故X的体积分数增大,平衡正向移动,故气体Y的转化率增大;由于冲入气体X,故气体的总的物质的量增大,故Z的体积分数减少,故B正确;
C.该反应的正反应是放热反应,降低温度平衡正向移动,反应达到新平衡前v(逆)<v(正),故C错误;
D.保持其他条件不变,起始时向溶液中充入0.32mol气体X和0.32mol气体Y,投料比与原来相等,由于反应前后气体的体积相等,故新平衡与原平衡为等效平衡,故到达平衡时,n(Z)=0.08mol×$\frac{0.32+0.16}{0.16}$=0.24mol,故D错误;
故选B.
点评 本题考查化学反应速率的计算、化学平衡的影响因素、等效平衡等知识,难度中等.注意D选项中等效平衡的判断.

练习册系列答案
相关题目
12. 酸碱中和滴定是中学化学中重要的定量实验之一.
酸碱中和滴定是中学化学中重要的定量实验之一.
Ⅰ.某研究性学习小组准确进行了如下实验,称取1.00g不纯的苛性钠样品配成250ml溶液,取出10.00ml,用已知浓度为0.040mol•L-1的盐酸进行滴定(杂质不与盐酸反应).
根据要求回答下列问题:
(1)配制250mL 0.040mol•L-1的盐酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管和250mL容量瓶.
(2)为测定该苛性钠溶液的准确浓度,几次滴定消耗盐酸的体积如下:
①计算苛性钠浓度时,哪次实验的数据不宜采用?答:3.(填实验序号)
②该苛性钠溶液的浓度为0.080 mol•L-1.
(3)若操作过程中未用盐酸润洗滴定管,对测定结果有怎样的影响?答:偏大(填“偏大”、“偏小”或“无影响”).
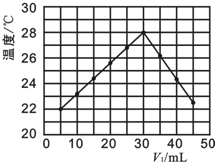
Ⅱ.在另一次实验中,研究性小组将V1 mL 1.0mol•L-1 HCl溶液和V2 mL 未知浓度的NaOH溶液均匀混合后,测量并记录溶液温度,实验结果如右图所示(实验中始终保持V1+V2=50mL).
(4)下列叙述中正确的是B
A.该实验的环境温度为22℃
B.当V1=40时,溶液中c(Na+)<c(Cl-)
C.NaOH溶液的浓度为1.0mol•L-1
D.保持其他条件不变,只将HCl改为CH3COOH
进行实验,也得到如图的实验结果.
 酸碱中和滴定是中学化学中重要的定量实验之一.
酸碱中和滴定是中学化学中重要的定量实验之一.Ⅰ.某研究性学习小组准确进行了如下实验,称取1.00g不纯的苛性钠样品配成250ml溶液,取出10.00ml,用已知浓度为0.040mol•L-1的盐酸进行滴定(杂质不与盐酸反应).
根据要求回答下列问题:
(1)配制250mL 0.040mol•L-1的盐酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管和250mL容量瓶.
(2)为测定该苛性钠溶液的准确浓度,几次滴定消耗盐酸的体积如下:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗盐酸溶液的体积(mL) | 20.05 | 20.00 | 22.10 | 19.95 |
②该苛性钠溶液的浓度为0.080 mol•L-1.
(3)若操作过程中未用盐酸润洗滴定管,对测定结果有怎样的影响?答:偏大(填“偏大”、“偏小”或“无影响”).
Ⅱ.在另一次实验中,研究性小组将V1 mL 1.0mol•L-1 HCl溶液和V2 mL 未知浓度的NaOH溶液均匀混合后,测量并记录溶液温度,实验结果如右图所示(实验中始终保持V1+V2=50mL).
(4)下列叙述中正确的是B
A.该实验的环境温度为22℃
B.当V1=40时,溶液中c(Na+)<c(Cl-)
C.NaOH溶液的浓度为1.0mol•L-1
D.保持其他条件不变,只将HCl改为CH3COOH
进行实验,也得到如图的实验结果.
2.如图a、b、c、d均为石墨电极,通电进行电解(电解液足量)下列说法正确的是( )
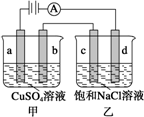

| A. | 向乙中加入适量盐酸,溶液组成可以恢复 | |
| B. | 电解时向乙中滴入酚酞溶液,c电极附近变红 | |
| C. | 当b极有64gCu析出时,c电极产生2g气体 | |
| D. | 甲中a极上的电极反应式为:4OH--4e-=O2↑+2H2O |
9.工业炼铁是在高炉中进行的,高炉炼铁的主要反应是:
①2C(焦炭)+O2(空气)$\frac{\underline{\;高温\;}}{\;}$2CO②Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2
该炼铁工艺中,对焦炭的实际使用量要远远高于按照化学方程式计算所需其主要原因是( )
①2C(焦炭)+O2(空气)$\frac{\underline{\;高温\;}}{\;}$2CO②Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2
该炼铁工艺中,对焦炭的实际使用量要远远高于按照化学方程式计算所需其主要原因是( )
| A. | CO过量 | B. | CO与铁矿石接触不充分 | ||
| C. | 炼铁高炉的高度不够 | D. | CO与Fe2O3的反应有一定限度 |
6.0.1mol•L-1的Na2S溶液中,下面说法正确的是( )
| A. | c(Na+)+c(H+)=c(OH-)+c(HS-)+c(S2-) | B. | c(Na+)=2c(HS-)+2c(S2-)+c(H2S) | ||
| C. | c(Na+)>c(OH-)>c(HS-)>c(H+) | D. | c(H2S)+c(HS-)+c(H+)=c(OH-) |
7.分子式为C4H8O2,只含一种官能团且为含氧官能团的有机物有(不考虑立体异构)( )
| A. | 15种 | B. | 6种 | C. | 4种 | D. | 2种 |
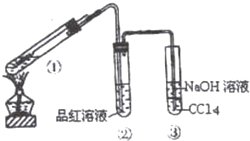 在用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应.
在用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应.