题目内容
13.某校课外活动小组同学设计实验,探究木炭与浓硫酸在加热条件下反应生成气体的成分.
【实验探究】
(1)木炭与浓硫酸反应的化学方程式:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
(2)图1A装置中品红溶液颜色褪色(填“褪色”或“不褪色”),证明含有SO2气体;
(3)图1装置B的作用是除去某种气体,这主要是利用了该气体的还原性性质来实现目的;
【实验讨论】
(4)有同学对B装置能否除尽SO2气体有疑义.你认为应该在B、C装置之间连接图2中的A装置,以确认SO2是否除尽;
【联系实际】
(5)煤和石油的燃烧过程中都有二氧化硫和二氧化碳排放,其中二氧化硫造成的环境影响主要是A,二氧化碳造成的环境影响主要是C.(每空格只填一个选项)
A.酸雨 B.破坏臭氧层 C.温室效应 D.光化学烟雾.
分析 (1)碳与浓硫酸在加热条件下反应生成二氧化碳、二氧化硫和水;
(2)二氧化硫具有漂白性,能够使品红溶液褪色,据此可以检验二氧化硫;
(3)二氧化硫具有还原性,能够被酸性高锰酸钾溶液氧化;
(4)用品红溶液具有是否存在二氧化硫气体;
(5)空气中含有大量二氧化硫气体,会组成酸雨现象;温室效应的罪魁祸首为二氧化碳.
解答 解:(1)碳与浓硫酸反应的化学方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
(2)反应中有二氧化硫生成,则图1A装置中品红溶液颜色褪色,证明了混合气体中含有SO2,
故答案为:褪色; SO2(或二氧化硫);
(3)酸性高锰酸钾溶液能够氧化二氧化硫,从而可以除去二氧化硫,证明了二氧化硫具有还原性,
故答案为:还原性;
(4)二氧化硫能够使品红溶液褪色,应该在B、C装置之间连接图2中的A-品红溶液,用于检验二氧化硫气体是否除尽,
故答案为:a;
(5)煤和石油的燃烧过程中都有二氧化硫和二氧化碳排放,其中二氧化硫造成的环境影响主要是酸雨,所以A正确;二氧化碳造成的环境影响主要是温室效应,所以C正确,
故答案为:A;C.
点评 本题考查了浓硫酸的性质,题目难度中等,明确浓硫酸与碳的反应原理及二氧化硫、二氧化碳的检验方法为解答关键,注意检验二氧化碳时,必须排除二氧化硫的干扰,为易错点.

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案
相关题目
8.某化学兴趣小组设计如图所示装置来检验浓硫酸与木炭粉在加热条件下反应产生的所有气体产物.下列说法不正确的是( )
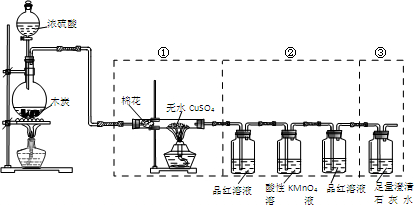

| A. | 实验时可观察到装置①中白色硫酸铜粉末变蓝色 | |
| B. | 装置②中前后两次观察到品红溶液的现象应不相同 | |
| C. | 装置③用于检验产物中二氧化碳气体的生成 | |
| D. | 如果将仪器的连接顺序变为②③①,同样可以检出所有气体产物 |
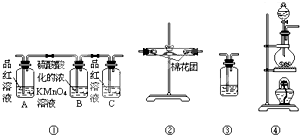 已知:SO2可以与硫酸酸化的浓KMnO4溶液反应,也可以使澄清的石灰水变浑浊.如图④中浓硫酸与木炭粉在加热条件下发生反应生成CO2、SO2和H2O.
已知:SO2可以与硫酸酸化的浓KMnO4溶液反应,也可以使澄清的石灰水变浑浊.如图④中浓硫酸与木炭粉在加热条件下发生反应生成CO2、SO2和H2O.
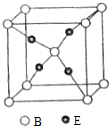
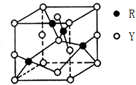 X、Y、Z、R为前四周期元素,原子序数依次增大.X、Y同周期,X基态原子的最外层电子数是次外层的2倍,Y基态原子的s能级和p能级上电子数相等;Z是地壳中含量最高的金属元素;R+离子的3d轨道全充满.
X、Y、Z、R为前四周期元素,原子序数依次增大.X、Y同周期,X基态原子的最外层电子数是次外层的2倍,Y基态原子的s能级和p能级上电子数相等;Z是地壳中含量最高的金属元素;R+离子的3d轨道全充满.