题目内容
10.某化学兴趣小组的同学,在实验室做锌与浓硫酸反应的实验时.甲同学认为产生的气体是二氧化硫.而乙同学认为除二氧化硫气体外,还可能产生氢气.为了验证甲、乙两位同学的判断是否正确.丙同学设计了如图所示的实验装置(锌与浓硫酸共热时产生的气体为X,且该制取装置略去):试回答: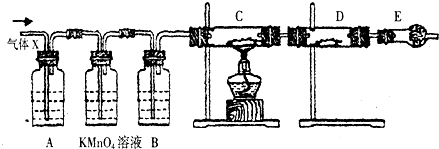
(1)锌与浓硫胶反应生成二氧化硫的化学方程式为Zn+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ZnSO4+SO2↑+2H2O.
(2)乙同学认为还可能产生氢气的化学方程式为Zn+H2SO4=ZnSO4+H2↑.
(3)A中存放的试剂可能是品红溶液,作用是检测SO2.
(4)可以证明气体X中含有氢气的实验现象是:C中:黑色的CuO变成红色的Cu;D中:白色粉末变成蓝色.
分析 (1)锌和浓硫酸反应是二氧化硫、硫酸锌和水;
(2)浓H2SO4浓度逐渐变稀,Zn与稀H2SO4反应可产生H2;
(3)装置A是验证二氧化硫存在的装置,二氧化硫能够使品红溶液褪色;
(5)氢气和氧化铜反应生成铜和水,水和无水硫酸铜反应生成蓝色的五水硫酸铜.
解答 解:(1)锌和浓硫酸反应是二氧化硫、硫酸锌和水,反应的化学方程式为:Zn+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ZnSO4+SO2↑+2H2O,
故答案为:Zn+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ZnSO4+SO2↑+2H2O;
(2)反应过程中浓H2SO4浓度逐渐变稀,Zn与稀H2SO4反应可产生H2,反应的化学方程式为:Zn+H2SO4=ZnSO4+H2↑,
故答案为:Zn+H2SO4=ZnSO4+H2↑;
(3)分析装置图可知,生成的气体中有二氧化硫和氢气,所以装置A是验证二氧化硫存在的装置,选品红溶液进行验证,
故答案为:品红溶液;检测SO2;
(4)为了检验氢气的存在,氢气与氧化铜在加热条件下反应生成铜和水,该反应的化学方程式为:H2+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O,黑色CuO变成红色的Cu,需用无水硫酸铜检验氢气被氧化的产物水,水和无水硫酸铜反应生成蓝色的五水合硫酸铜,所以可以证明气体X中含有H2的实验现象是:C中黑色CuO变成红色的Cu,D中白色粉末变成蓝色,
故答案为:黑色的CuO变成红色的Cu;白色粉末变成蓝色.
点评 本题考查锌和硫酸的反应及产物的检验,题目难度中等,注意掌握浓硫酸的性质,根据需检验气体的性质、检验方法理解检验的先后顺序是解答的关键.

 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案| 物质 | A | NaCl | KCl | CaCl2 |
| 熔点(K) | 1074 | 918 | ||
| 物质 | B | Na | Mg | Al |
| 熔点(K) | 317 | 923 | 933 |
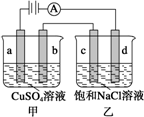
| A. | 向乙中加入适量盐酸,溶液组成可以恢复 | |
| B. | 电解时向乙中滴入酚酞溶液,c电极附近变红 | |
| C. | 当b极有64gCu析出时,c电极产生2g气体 | |
| D. | 甲中a极上的电极反应式为:4OH--4e-=O2↑+2H2O |
| 选项 | 实验操作 | 现象 | 结论 |
| A | 蘸有浓氨水的玻璃棒靠近某溶液 | 有白烟产生 | 该溶液可能是浓盐酸 |
| B | 将SO2通入Ba(NO3)2溶液 | 产生白色沉淀 | SO2与可溶性钡盐均可生成白色沉淀 |
| C | 向Zn与稀硫酸反应的溶液中滴加硫酸铜溶液 | 产生气体的速率加快 | 硫酸铜作该反应的催化剂 |
| D | 用铂丝蘸取少量某溶液进行焰色反应 | 火焰呈黄色 | 该溶液一定是钠盐溶液 |
| A. | A | B. | B | C. | C | D. | D |
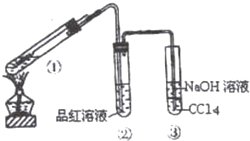 在用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应.
在用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应.