10.金属镍有广泛的用途.粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍.下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)( )
| A. | 电解后,电解槽底部的阳极泥中只有金属Pt | |
| B. | 电解过程中,电解质溶液的质量可能保持不变 | |
| C. | 电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+ | |
| D. | 阳极发生氧化反应,其电极反应式:Ni2++2e-═Ni |
9.将lmol纯净的A置于特制的真空密闭容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其分解送到平衡:A(s)=2B(g)+C(g)下列可以判断该反应己经达到化学平衡状态的是( )
| A. | 反应速率VB(正)=VC(逆) | B. | B、C物质的量之比保持不变 | ||
| C. | B的体积分数不变 | D. | 混合气体的密度保持不变 |
8.下列有关实验操作错误的是( )
| A. | 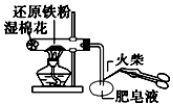 验铁粉与水蒸气反应产生的氢气 | |
| B. |  分离两种互溶但沸点相差较大的液体混合物 | |
| C. |  乙酸乙酯的制备演示实验 | |
| D. |  碳酸氢钠受热分解 |
7.下列表达正确的是( )
| A. | N2的电子式为: | B. | H2O2的电子式为 | ||
| C. | 用电子式表示Na2O的形成过程为: | D. | MgCl2的电子式为: |
6. 常温下,向1L0.1mol/LH2A溶液中逐渐加入等浓度NaOH溶液,所得溶液中含A元 素的微粒的物质的量分数和溶液pH的关系如图所示,则下列说法中正确的是( )
常温下,向1L0.1mol/LH2A溶液中逐渐加入等浓度NaOH溶液,所得溶液中含A元 素的微粒的物质的量分数和溶液pH的关系如图所示,则下列说法中正确的是( )
 常温下,向1L0.1mol/LH2A溶液中逐渐加入等浓度NaOH溶液,所得溶液中含A元 素的微粒的物质的量分数和溶液pH的关系如图所示,则下列说法中正确的是( )
常温下,向1L0.1mol/LH2A溶液中逐渐加入等浓度NaOH溶液,所得溶液中含A元 素的微粒的物质的量分数和溶液pH的关系如图所示,则下列说法中正确的是( )| A. | H2A的电离方程式为:H2A?H++HA-,HA-?H++A2- | |
| B. | 0.1mol/LNaHA溶液中存在c(A2-)+c(HA-)+c(H2A)=0.1mol/L | |
| C. | 常温下,等物质的量浓度的NaHA与Na2A溶液等体积混合后c(A2-)=c(HA-) | |
| D. | pH=4.0时,HA-电离常数为10-3 |
5.下列实验不能达到预期目的是( )
| 实验操作 | 实验目的 | |
| A | 浓、稀HNO3分别与Cu 反应 | 比较浓、稀HNO3的酸性强弱 |
| B | MgCl2、AlCl3溶液中分别加入过量NaOH溶液 | 比较镁、铝的金属性强弱 |
| C | 测定等浓度的H3PO4、H2SO4两溶液的pH大小 | 比较磷、硫的非金属性强弱 |
| D | 用等浓度的盐酸、碳酸氢钠两溶液混合反应 | 比较盐酸、碳酸的酸性强弱 |
| A. | A | B. | B | C. | C | D. | D |
3. 常温下,将11.65g BaSO4粉末置于盛有250mL蒸馏水的烧杯中,然后向烧杯中加入Na2CO3固体(忽视溶液体积的变化)并充分搅拌,加入Na2CO3固体的过程中,溶液中几种离子的浓度变化曲线如图所示,下列说法中正确的是
常温下,将11.65g BaSO4粉末置于盛有250mL蒸馏水的烧杯中,然后向烧杯中加入Na2CO3固体(忽视溶液体积的变化)并充分搅拌,加入Na2CO3固体的过程中,溶液中几种离子的浓度变化曲线如图所示,下列说法中正确的是
( )
 常温下,将11.65g BaSO4粉末置于盛有250mL蒸馏水的烧杯中,然后向烧杯中加入Na2CO3固体(忽视溶液体积的变化)并充分搅拌,加入Na2CO3固体的过程中,溶液中几种离子的浓度变化曲线如图所示,下列说法中正确的是
常温下,将11.65g BaSO4粉末置于盛有250mL蒸馏水的烧杯中,然后向烧杯中加入Na2CO3固体(忽视溶液体积的变化)并充分搅拌,加入Na2CO3固体的过程中,溶液中几种离子的浓度变化曲线如图所示,下列说法中正确的是( )
| A. | 相同温度时,Ksp(BaSO4)>Ksp(BaCO3) | |
| B. | BaSO4在水中的溶解度、Ksp均比在BaCl2溶液中的大 | |
| C. | 若使0.05molBaSO4全部转化为BaCO3,至少要加入1.25molNa2CO3 | |
| D. | 0.05molBaSO4恰好全部转化为BaCO3时,溶液中离子浓度大小为:c(CO32-)>c(SO42-)>c(OH-)>c(Ba2+) |
2.氮的氧化物处理和利用是环境科学研究的热点.
Ⅰ.碱吸法.用烧碱溶液吸收NO、NO2制备亚硝酸盐:
2NaOH+NO2+NO═2NaNO2+H2O,
2NO2+2NaOH═NaNO2+H2O.
已知:298K时,Ka(HNO2)=5×10-4
(1)298K时,NaNO2的水解常数约为2.0×10-11.
Ⅱ.电解法.工业上以石墨为电极,用硝酸铵稀溶液作电解质溶液电解NO获得氮肥(在电解后溶液中通入适量氨气),其原理为8NO+7H2O+2NH3$\frac{\underline{\;通电\;}}{\;}$5NH4NO3
(2)阴极的电极反应式为NO+5e-+6H+═NH4++H2O
(3)阳极区电解质溶液的pH减小 (填“增大”“减小”或“不变”).
Ⅲ.化合法.亚硝酸酰氯(NOCl)是有机合成中的重要试剂,可用NO和Cl2反应得到,化学方程式为2NO(g)+Cl2(g)?2NOCl(g).
(4)氮氧化物与悬浮大气中的海盐粒子相互作用会生成NOCl,涉及的相关反应有:
△H1、△H2、△H3之间的关系为△H3=2△H1-△H2;K3=$\frac{{K}_{1}^{2}}{{K}_{2}}$(用含K1、K2的关系式表示).
(5)在2L恒容容器中充入4molNO(g)和2molCl2(g),在不同温度下测得c(NOCl)与时间(t)的关系如图1所示.

①T2时反应0~10min内NOCl的平均反应速率v(NOCl)=0.05mol•L-1•min-1
②T2时反应的平衡常数K为$\frac{1}{6.75}$L/mol;NO的平衡转化率α(NO)为25%.
③T2时向上述平衡体系中再加入1molNO(g)、1molCl2(g)、2molNOCl(g),则平衡向左 (填“向左”“向右”或“不”)移动.
(6)在密闭容器中充入NO(g)和Cl2(g),改变外界条件,Cl2的转化率变化如图2所示.则该条件可能为B (填字母).
A.升高温度 B.增大压强 C.增大起始投料比$\frac{c(C{l}_{2})}{c(NO)}$ D.增大催化剂接触面.
0 163532 163540 163546 163550 163556 163558 163562 163568 163570 163576 163582 163586 163588 163592 163598 163600 163606 163610 163612 163616 163618 163622 163624 163626 163627 163628 163630 163631 163632 163634 163636 163640 163642 163646 163648 163652 163658 163660 163666 163670 163672 163676 163682 163688 163690 163696 163700 163702 163708 163712 163718 163726 203614
Ⅰ.碱吸法.用烧碱溶液吸收NO、NO2制备亚硝酸盐:
2NaOH+NO2+NO═2NaNO2+H2O,
2NO2+2NaOH═NaNO2+H2O.
已知:298K时,Ka(HNO2)=5×10-4
(1)298K时,NaNO2的水解常数约为2.0×10-11.
Ⅱ.电解法.工业上以石墨为电极,用硝酸铵稀溶液作电解质溶液电解NO获得氮肥(在电解后溶液中通入适量氨气),其原理为8NO+7H2O+2NH3$\frac{\underline{\;通电\;}}{\;}$5NH4NO3
(2)阴极的电极反应式为NO+5e-+6H+═NH4++H2O
(3)阳极区电解质溶液的pH减小 (填“增大”“减小”或“不变”).
Ⅲ.化合法.亚硝酸酰氯(NOCl)是有机合成中的重要试剂,可用NO和Cl2反应得到,化学方程式为2NO(g)+Cl2(g)?2NOCl(g).
(4)氮氧化物与悬浮大气中的海盐粒子相互作用会生成NOCl,涉及的相关反应有:
| 热化学方程式 | 平衡常数 | |
| ① | 2NO2(g)+NaCl(s)?NaNO3(s)+NOCl(g)△H1 | K1 |
| ② | 4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g)△H2 | K2 |
| ③ | 2NO(g)+Cl2(g)?2NOCl(g)△H3 | K3 |
(5)在2L恒容容器中充入4molNO(g)和2molCl2(g),在不同温度下测得c(NOCl)与时间(t)的关系如图1所示.

①T2时反应0~10min内NOCl的平均反应速率v(NOCl)=0.05mol•L-1•min-1
②T2时反应的平衡常数K为$\frac{1}{6.75}$L/mol;NO的平衡转化率α(NO)为25%.
③T2时向上述平衡体系中再加入1molNO(g)、1molCl2(g)、2molNOCl(g),则平衡向左 (填“向左”“向右”或“不”)移动.
(6)在密闭容器中充入NO(g)和Cl2(g),改变外界条件,Cl2的转化率变化如图2所示.则该条件可能为B (填字母).
A.升高温度 B.增大压强 C.增大起始投料比$\frac{c(C{l}_{2})}{c(NO)}$ D.增大催化剂接触面.
 CuSO4和Cu(NO3)2是自然界中重要的铜盐.请回答下列问题:
CuSO4和Cu(NO3)2是自然界中重要的铜盐.请回答下列问题: (用箭头表示出配位键的位置)
(用箭头表示出配位键的位置)
 .
. +O2$→_{△}^{催化剂}$2
+O2$→_{△}^{催化剂}$2 .
.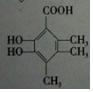 .
.