题目内容
8.下列有关实验操作错误的是( )| A. | 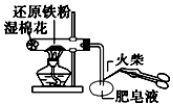 验铁粉与水蒸气反应产生的氢气 | |
| B. |  分离两种互溶但沸点相差较大的液体混合物 | |
| C. |  乙酸乙酯的制备演示实验 | |
| D. |  碳酸氢钠受热分解 |
分析 A.铁粉与水蒸气反应生成氢气,可用点燃的方法检验;
B.可用蒸馏的方法分离沸点不同的液体混合物;
C.乙酸、乙醇在浓硫酸作用下发生酯化反应生成乙酸乙酯,可用饱和碳酸钠溶液吸收并除杂;
D.加热固体时应防止试管炸裂.
解答 解:A.铁粉与水蒸气反应生成氢气,通入肥皂液可形成肥皂泡,可用点燃的方法检验,故A正确;
B.可用蒸馏的方法分离沸点不同的液体混合物,温度计以及水流方向都正确,故B正确;
C.乙酸、乙醇在浓硫酸作用下发生酯化反应生成乙酸乙酯,乙酸乙酯不溶于饱和碳酸钠溶液,乙酸可与碳酸钠反应,且乙醇易溶于水,可用饱和碳酸钠溶液吸收并除杂,故C正确;
D.加热固体时,为防止水倒流而导致试管炸裂,试管口应向下倾斜,故D错误.
故选D.
点评 本题综合考查化学实验方案的评价,为高考常见题型,题目涉及气体的制备,物质的分离以及性质实验的等基本操作,侧重考查学生的分析能力和实验能力,注意把握物质的性质以及实验的基本操作方法,难度不大.

练习册系列答案
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案
相关题目
4.对下列事故预防或处理方法正确的是( )
| A. | 浓NaOH溶液溅到皮肤上,立即用水冲洗,然后涂上稀硫酸 | |
| B. | 欲配置500 mL l mol/LNaOH溶液,应将20gNaOH固体溶于500 mL水中 | |
| C. | 稀释浓硫酸时,为防止液体飞溅,将浓硫酸沿烧杯壁缓缓加入水中,并不断搅拌 | |
| D. | 钠着火时用二氧化碳灭火 |
5.以下有机物既能发生消去反应生成相应的烯烃,又能氧化生成相应的醛的是( )
| A. | CH3OH | B. | HOCH2CH(CH3)2 | C. | (CH3)3COH | D. | CH3CHOHCH2CH3 |
2. 短周期元素Q、R、T、W在周期表中的位置如图所示,其中,T所处周期序数与主族序数相等,则下列说法正确的是( )
短周期元素Q、R、T、W在周期表中的位置如图所示,其中,T所处周期序数与主族序数相等,则下列说法正确的是( )
 短周期元素Q、R、T、W在周期表中的位置如图所示,其中,T所处周期序数与主族序数相等,则下列说法正确的是( )
短周期元素Q、R、T、W在周期表中的位置如图所示,其中,T所处周期序数与主族序数相等,则下列说法正确的是( )| A. | 元素R的最高价氧化物对应的水化物是高沸点酸 | |
| B. | 元素T和W各自形成的简单离子都能促进水的电离 | |
| C. | 简单离子半径:W>T>R | |
| D. | 常温下,T的单质能完全溶于R的最高价氧化物的水化物的浓溶液中 |
3. 常温下,将11.65g BaSO4粉末置于盛有250mL蒸馏水的烧杯中,然后向烧杯中加入Na2CO3固体(忽视溶液体积的变化)并充分搅拌,加入Na2CO3固体的过程中,溶液中几种离子的浓度变化曲线如图所示,下列说法中正确的是
常温下,将11.65g BaSO4粉末置于盛有250mL蒸馏水的烧杯中,然后向烧杯中加入Na2CO3固体(忽视溶液体积的变化)并充分搅拌,加入Na2CO3固体的过程中,溶液中几种离子的浓度变化曲线如图所示,下列说法中正确的是
( )
 常温下,将11.65g BaSO4粉末置于盛有250mL蒸馏水的烧杯中,然后向烧杯中加入Na2CO3固体(忽视溶液体积的变化)并充分搅拌,加入Na2CO3固体的过程中,溶液中几种离子的浓度变化曲线如图所示,下列说法中正确的是
常温下,将11.65g BaSO4粉末置于盛有250mL蒸馏水的烧杯中,然后向烧杯中加入Na2CO3固体(忽视溶液体积的变化)并充分搅拌,加入Na2CO3固体的过程中,溶液中几种离子的浓度变化曲线如图所示,下列说法中正确的是( )
| A. | 相同温度时,Ksp(BaSO4)>Ksp(BaCO3) | |
| B. | BaSO4在水中的溶解度、Ksp均比在BaCl2溶液中的大 | |
| C. | 若使0.05molBaSO4全部转化为BaCO3,至少要加入1.25molNa2CO3 | |
| D. | 0.05molBaSO4恰好全部转化为BaCO3时,溶液中离子浓度大小为:c(CO32-)>c(SO42-)>c(OH-)>c(Ba2+) |
13.NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 体积为1L、浓度为1mol/L的H2SO4和H3PO4溶液中所含氧原子数目均为4NA | |
| B. | 1molFe在71g Cl2中完全燃烧转移的电子数为3NA | |
| C. | 25℃时,pH=13的NaOH溶液中含有OH-的数目为NA | |
| D. | 25℃、101KPa下,22.4L氯气通入NaOH溶液中充分反应,转移的电子数小于NA |
20.有一种新型的锂电池,其制作是利用了金属锂和石墨作电极,其电解质溶液是四氯合铝酸锂(LiAlCl4)溶解在二氯亚硫酰(其化学式是SOCl2)中形成的,原电池的电极总反应式是:8Li+3SOCl2═6LiCl+Li2SO3+2S,下列关于这种新型电池的说法中错误的是( )
| A. | 锂作为电池的负极,石墨作电池的正极 | |
| B. | 电池工作过程中,SOCl2被还原为Li2SO3 | |
| C. | 该电池内环境应该是无水环境,否则影响电池的寿命 | |
| D. | 电池工作时,锂提供的电子的物质的量与析出硫的物质的量之比是4:1 |
17.已知25℃时,CH3COOH、HCN和H2CO3的电离常数如表:
下列有关叙述错误的是( )
| CH3COOH | HCN | H2CO3 |
| K=1.75×10-5 | K=4.9×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
| A. | 向NaCN溶液中通入少量CO2的离子方程式:CN-+H2O+CO2═HCN+HCO3- | |
| B. | 25℃时,反应CH3COOH+CN-?HCN+CH3COO-的化学平衡常数为3.57×104 | |
| C. | 中和等体积、等物质的量浓度的CH3COOH和HCN溶液,消耗NaOH的量前者小于后者 | |
| D. | 等物质的量浓度的CH3COONa和NaCN混合溶液中:c(CH3COO-)>c(CN-)>c(OH-)>c(H+) |
1.现有两个热化学方程式:下列说法中正确的是( )


| A. | 反应①②中都存在:△S>0 | B. | 反应②高温时,可自发进行 | ||
| C. | 在通常情况下,①②都能自发进行 | D. | 反应①一定不能自发进行 |