题目内容
6. 常温下,向1L0.1mol/LH2A溶液中逐渐加入等浓度NaOH溶液,所得溶液中含A元 素的微粒的物质的量分数和溶液pH的关系如图所示,则下列说法中正确的是( )
常温下,向1L0.1mol/LH2A溶液中逐渐加入等浓度NaOH溶液,所得溶液中含A元 素的微粒的物质的量分数和溶液pH的关系如图所示,则下列说法中正确的是( )| A. | H2A的电离方程式为:H2A?H++HA-,HA-?H++A2- | |
| B. | 0.1mol/LNaHA溶液中存在c(A2-)+c(HA-)+c(H2A)=0.1mol/L | |
| C. | 常温下,等物质的量浓度的NaHA与Na2A溶液等体积混合后c(A2-)=c(HA-) | |
| D. | pH=4.0时,HA-电离常数为10-3 |
分析 由图可知0.1mol/L H2A溶液中全部电离为HA-,说明第一步电离为完全电离,pH=3.0时,c(A2-)=c(HA-),可计算HA-电离常数,且电离常数只受温度的影响,结合物料守恒解答该题.
解答 解:A.由图可知0.1mol/L H2A溶液中全部电离为HA-,说明第一步电离为完全电离,所以H2A的电离方程式为:H2A=H++HA-,HA-?H++A2-,故A错误;
B.H2A溶液中全部电离,不存在H2A分子,则由物料守恒可知,c(A2-)+c(HA-)=0.1mol/L,故B错误;
C.pH=3.0时,c(A2-)=c(HA-),可知HA-电离常数为10-3,则A2-的水解常数为$\frac{1{0}^{-14}}{1{0}^{-3}}$=10-11,A2-的水解程度小于HA-的电离程度,则c(A2-)>c(HA-),故C错误;
D.pH=3.0时,c(A2-)=c(HA-),HA-电离常数为$\frac{c({A}^{2-})c({H}^{+})}{c(H{A}^{-})}$=10-3,而常数只受温度的影响,可知相同温度下pH=4.0时,HA-电离常数仍为10-3,故D正确.
故选D.
点评 本题考查了弱电解质的电离、电离常数的有关计算,题目难度中等,注意把握弱电解质电离常数的有关计算方法,侧重于考查学生的分析能力、计算能力以及对图象中信息的应用能力.

练习册系列答案
相关题目
3.X、Y两元素可形成XY3型共价化合物,则X、Y最外层的电子排布可能是( )
| A. | X:3s23p1 Y:3s23p4 | B. | X:2s22p3 Y:2s22p4 | ||
| C. | X:3s23p1 Y:2s22p5 | D. | X:2s22p3 Y:1s1 |
20.下列三种有机物是某些药物中的有效成分:

以下说法正确的是( )

以下说法正确的是( )
| A. | 将各1mol的三种物质分别与氢氧化钠溶液充分反应,阿司匹林消耗氢氧化钠最多 | |
| B. | 三种有机物苯环上的氢原子若被氯原子取代,其一氯代物都只有2种 | |
| C. | 三种有机物中的所有原子不可能共平面 | |
| D. | 三种有机物都能与浓溴水发生反应 |
18. 金属(M)-空气电池(如图)具有原料易得,能量密度高等优点,有望成为新能源汽车和移动设备的电源,该类电池放电的总反应方程式为:4M+nO2+2nH2O═4M(OH)n,己知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能,下列说法不正确的是( )
金属(M)-空气电池(如图)具有原料易得,能量密度高等优点,有望成为新能源汽车和移动设备的电源,该类电池放电的总反应方程式为:4M+nO2+2nH2O═4M(OH)n,己知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能,下列说法不正确的是( )
 金属(M)-空气电池(如图)具有原料易得,能量密度高等优点,有望成为新能源汽车和移动设备的电源,该类电池放电的总反应方程式为:4M+nO2+2nH2O═4M(OH)n,己知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能,下列说法不正确的是( )
金属(M)-空气电池(如图)具有原料易得,能量密度高等优点,有望成为新能源汽车和移动设备的电源,该类电池放电的总反应方程式为:4M+nO2+2nH2O═4M(OH)n,己知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能,下列说法不正确的是( )| A. | 采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面 | |
| B. | 在Mg-空气电池中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜 | |
| C. | M-空气电池放电过程的正极反应式:正极反应式为O2+2H2O+4e-═4OH- | |
| D. | 比较Mg、Al、Zn三种金属-空气电池,Mg-空气电池的理论比能量最高 |
15.下列实验中,对应的现象以及结论均正确的是( )
| 选项 | 实验 | 现象 | 结论 |
| 向淀粉水解后的溶液中加入碘水 | 溶液变蓝色 | 淀粉没有水解 | |
| 将苯滴入溴水中,振荡,静置 | 溴水层褪色 | 溴和苯发生加成反应 | |
| 向1.0mol•L-1的NaHCO3溶液中滴加2滴甲基橙 | 溶液呈黄色 | NaHCO3溶液呈碱性 | |
| 相同的铝片分别与同温同体积,且c(H+)=1mol•L-1的盐酸、硫酸反应 | 铝与盐酸反应产生气泡较快 | 可能是Cl-对该反应起到促进作用 |
| A. | A | B. | B | C. | C | D. | D |
19.亚硝酰氯(NOC1)是有机合成中的重要试剂,可由NO和Cl2反应得到,化学方程式为 2NO(g)+Cl2(g)=2NOCl(g).
(1)已知几种化学键的键能数据如下表(亚硝酸氯的结构式为Cl-N=0):
则 2N0(g)+Cl2(g)=2NOCl(g)△H=289-2aKJ•mol-1 (用含a 的式子表示).
(2)300℃时,在恒容密闭容器中发生反应:2NOC1(g)═2NO(g)+Cl2(g).该反应速率的表达式为v正=k•cn(NOCl)(k为速率常数,只与温度有关),正反应速率与浓度的关系如表所示:
计算:n=2,k=4.0×10-7mol-1•L•s-1.
(3)在2L恒容密闭容器中充入4mo1NO(g)和2mol Cl2(g),f发生反应2NO(g)+Cl2(g)═2NOCl (g).在不同温度下c(NOCl)与时间t的关系如图Ⅰ所示:

①判断:Tl<T2;此反应的△H<0 (两空均填“>”“<”或“=”).
②反应开始到lOmin时平均反应速率v(NO)=0.1mol•L-1•min-1.
③T2时此反应的平衡常数K=2L/mol.
(4)在密闭容器中充入NO(g)和Cl2(g),发生反应2NO(g)+Cl2(g)-2NOCl(g).改变外界条件X,NO的转化率变化关系如图Ⅱ所示,则X可能是BC(填标号).
A.温度 B.压强C.$\frac{n(C{l}_{2})}{n(NO)}$ D.与催化剂的接触面积.
(1)已知几种化学键的键能数据如下表(亚硝酸氯的结构式为Cl-N=0):
则 2N0(g)+Cl2(g)=2NOCl(g)△H=289-2aKJ•mol-1 (用含a 的式子表示).
(2)300℃时,在恒容密闭容器中发生反应:2NOC1(g)═2NO(g)+Cl2(g).该反应速率的表达式为v正=k•cn(NOCl)(k为速率常数,只与温度有关),正反应速率与浓度的关系如表所示:
| 序号 | c(NOCl)/mol•L-1 | v/mol•L-1•S-1 |
| ① | 0.30 | 3.60×10-9 |
| ② | 0.60 | 1.44×10-8 |
| ③ | 0.90 | 3.24×10-8 |
| 化学键 | NO中的氮氧键 | Cl-C1 键 | C1-N 键 | N0C1中的N=0键 |
| 键能/KJ•mol-1 | 630 | 243 | a | 607 |

①判断:Tl<T2;此反应的△H<0 (两空均填“>”“<”或“=”).
②反应开始到lOmin时平均反应速率v(NO)=0.1mol•L-1•min-1.
③T2时此反应的平衡常数K=2L/mol.
(4)在密闭容器中充入NO(g)和Cl2(g),发生反应2NO(g)+Cl2(g)-2NOCl(g).改变外界条件X,NO的转化率变化关系如图Ⅱ所示,则X可能是BC(填标号).
A.温度 B.压强C.$\frac{n(C{l}_{2})}{n(NO)}$ D.与催化剂的接触面积.
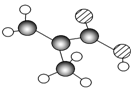 某物质只含C、H、O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键).
某物质只含C、H、O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键). .
. .
.
 .
. +O2$→_{△}^{催化剂}$2
+O2$→_{△}^{催化剂}$2 .
. .
. 硫酸是一种重要的基本化工原料,我国的硫磺资源相对短缺,主要用黄铁矿(FeS2,其中S为-1价)生产硫酸的重要原料,生产过程中主要有三个步骤:
硫酸是一种重要的基本化工原料,我国的硫磺资源相对短缺,主要用黄铁矿(FeS2,其中S为-1价)生产硫酸的重要原料,生产过程中主要有三个步骤: