题目内容
8.己知X、Y、Z、W为短周期四种常见元素,其中X是原子半径最小的元素,Y原子的最外层电子数是内层电子数二倍,Z能和X形成两种常见的液态化合物,W元素的单质既能与盐酸反应也能与NaOH溶液反应,请回答下列问题:(1)写出Y的元素符号:C
(2)写出X2Z2的电子式:
 ,属于共价(“离子”或“共价”)化合物.
,属于共价(“离子”或“共价”)化合物.(3)写出W的氧化物与NaOH溶液反应的离子方程式:Al2O3+2OH-=2AlO2-+H2O
(4)X的气体单质与Z的气体单质可制成新型的化学电源(KOH溶液做电解质溶液),两个电极由元素Y的某种多孔性单质制成,通入的气体由空隙中逸出,并在电极表面放电,则正极通入氧气(填物质名称),负极电极反应式为H2-2e-+2OH-=2H2O.
分析 X、Y、Z、W为短周期四种常见元素,其中X是原子半径最小的元素,则X为H元素;Y原子的最外层电子数是内层电子数二倍,原子只能有2个电子层,最外层电子数为4,故Y为C元素;Z能和X形成两种常见的液态化合物,则Z为O元素;W元素的单质既能与盐酸反应也能与NaOH溶液反应,则W为Al,据此解答.
解答 解:X、Y、Z、W为短周期四种常见元素,其中X是原子半径最小的元素,则X为H元素;Y原子的最外层电子数是内层电子数二倍,原子只能有2个电子层,最外层电子数为4,故Y为C元素;Z能和X形成两种常见的液态化合物,则Z为O元素;W元素的单质既能与盐酸反应也能与NaOH溶液反应,则W为Al.
(1)Y的元素符号为:C,故答案为:C;
(2)X2Z2为H2O2,电子式为: ,属于共价化合物,
,属于共价化合物,
故答案为: ;共价;
;共价;
(3)W的氧化物为Al2O3,与NaOH溶液反应的离子方程式:Al2O3+2OH-=2AlO2-+H2O,
故答案为:Al2O3+2OH-=2AlO2-+H2O;
(4)氢气、氧气可制成新型的化学电源(KOH溶液做电解质溶液),两个电极由元素碳的某种多孔性单质制成,正极发生还原反应,则正极通入氧气,负极上是氢气获得电子,碱性条件下生成水,负极电极反应式为:H2-2e-+2OH-=2H2O,
故答案为:氧气;H2-2e-+2OH-=2H2O.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,注意对基础知识的理解掌握,难度不大.

练习册系列答案
相关题目
19.风光互补LED照明系统广泛用于高速公路照明,其原理如图所示,图中涉及的能量转化方式有( )


| A. | 至少6种 | B. | 4种 | C. | 3种 | D. | 2种 |
16.在周期表中,下列各组元素位于同主族的是( )
| A. | Mg、Al | B. | Se,Br | C. | Si、Ge | D. | S、As |
3.把1OOmL2mol/L的H2SO4跟过量锌粉反应.在一定温度下,为了减缓反应速率而不影响生成H2的总量,可在反应物中加入适量的( )
| A. | 醋酸钠溶液 | B. | 硫酸铜溶液 | C. | 硝酸钠溶液 | D. | 氢氧化钠溶液 |
13.在下列物质中:①Al ②NaHCO3 ③Al2O3 ④(NH4)2S ⑤SiO2 ⑥Al(OH)3⑦AgNO3 ⑧Na2CO3既能和盐酸反应,又能后NaOH溶液反应的是( )
| A. | ①②③⑥ | B. | ①③④⑤⑧ | C. | ①②③④⑥⑦ | D. | 全部 |
17.如表是A、B、C、D、E五种有机物的有关信息;
根据表中信息回答下列问题:
(1)A与溴的四氯化碳溶液反应的生成物的名称叫做1,2-二溴乙烷;写出在一定条件下,A生成高分子化合物的化学反应方程式 .
.
(2)A与氢气发生加成反应后生成分子F,F在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2.当n=4时,这类有机物开始出现同分异构体.
(3)B具有的性质是②③(填号):①无色无味液体、②有毒、③不溶于水、④密度比水大、⑤与酸性KMnO4溶液和溴水反应褪色、⑥任何条件下不与氢气反应;写出在浓硫酸作用下,B与浓硝酸反应的化学方程式: .
.
(4)C与E反应能生成相对分子质量为100的酯,其化学反应方程式为:CH2=CHCOOH+CH3CH2OH$→_{△}^{浓硫酸}$CH2=CHCOOOCH2CH3+H2O.
(5)写出由D还原生成C的化学反应方程式:CH3CHO+H2 $\stackrel{催化剂}{→}$CH3CH2OH.
| A | B | C | D | E |
| ①能使溴的四氯化碳溶液褪色; ②比例模型为:  ③能与水在一定条件下反应生成C | ①由C、H两种元素组成; ②球棍模型为:  | ①由C、H、O三种元素组成; ②能与Na反应,但不能与NaOH溶液反应; ③能与E反应生成相对分子质量为100的酯. | ①相对分子质量比C少2; ②能由C氧化而成; | ①由C、H、O三种元素组成; ②球棍模型为: 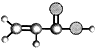 |
(1)A与溴的四氯化碳溶液反应的生成物的名称叫做1,2-二溴乙烷;写出在一定条件下,A生成高分子化合物的化学反应方程式
 .
.(2)A与氢气发生加成反应后生成分子F,F在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2.当n=4时,这类有机物开始出现同分异构体.
(3)B具有的性质是②③(填号):①无色无味液体、②有毒、③不溶于水、④密度比水大、⑤与酸性KMnO4溶液和溴水反应褪色、⑥任何条件下不与氢气反应;写出在浓硫酸作用下,B与浓硝酸反应的化学方程式:
 .
.(4)C与E反应能生成相对分子质量为100的酯,其化学反应方程式为:CH2=CHCOOH+CH3CH2OH$→_{△}^{浓硫酸}$CH2=CHCOOOCH2CH3+H2O.
(5)写出由D还原生成C的化学反应方程式:CH3CHO+H2 $\stackrel{催化剂}{→}$CH3CH2OH.
18.下列有关电解质溶液中粒子浓度关系正确的是( )
| A. | pH相同的①CH3COONa、②NaHCO3、③NaClO三种溶液的c(Na+):①>②>③ | |
| B. | 含有AgCl和AgI固体的悬浊液:c(Ag+)>c(Cl-)=c(I-) | |
| C. | CO2的水溶液:c(H+)>c(HCO3-)=2c(CO32-) | |
| D. | 含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] |
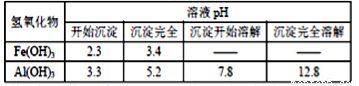
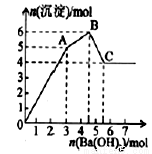
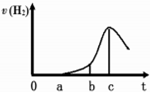 某兴趣小组进行“活泼金属与酸反应”的实验.将5.4g的铝片投入500mL0.5mol•L-1的硫酸溶液中,下图为反应产生氢气速率与反应时间的关系图.
某兴趣小组进行“活泼金属与酸反应”的实验.将5.4g的铝片投入500mL0.5mol•L-1的硫酸溶液中,下图为反应产生氢气速率与反应时间的关系图.