题目内容
5.甲烷燃料电池以铂丝为电极,KOH为电解质溶液,从两极分别通入甲烷和氧气即可产生电流.关于此燃料电池的下列叙述正确的是( )| A. | 通入CH4的电极为正极 | |
| B. | 正极的电极反应式为:202+8e-+4H20=80H- | |
| C. | 若甲烷通人量为1.12L(标准状况)且反应完全,则电池中有0.1mol02被氧化 | |
| D. | 通入甲烷的电极的电极反应式为:CH4+202+4e-=C02+2H20 |
分析 该燃料生成中,通入甲烷的电极是负极,负极反应式为CH4+10OH--8e-=CO32-+7H2O,通入氧气的一极为原电池的正极,发生还原反应,电极方程式为02+2H2O+4e-=40H-,总反应式为CH4+2O2+2KOH═K2CO3+3H2O,据此分析解答.
解答 解:该燃料生成中,通入甲烷的电极是负极,负极反应式为CH4+10OH--8e-=CO32-+7H2O,通入氧气的一极为原电池的正极,发生还原反应,电极方程式为02+2H2O+4e-=40H-,总反应式为CH4+2O2+2KOH═K2CO3+3H2O,
A.甲烷易失电子发生氧化反应,所以通入甲烷的电极是负极,故A错误;
B.电解质溶液呈碱性,正极上氧气得电子和水反应生成氢氧根离子,电极反应式为:202+8e-+4H20=80H-,故B正确;
C.氧气被还原,而不是被氧化,故C错误;
D.甲烷在反应时失电子被氧化,应为原电池负极反应,电极方程式为CH4+10OH--8e-=CO32-+7H2O,故D错误;
故选B.
点评 本题考查化学电源新型电池,为高频考点,明确正负极上发生的反应及电极反应式的书写是解本题关键,难点是电极反应式的书写,要结合电解质溶液酸碱性书写.

练习册系列答案
相关题目
15.下表列出部分化学键的键能:
据此判断下列说法正确的是( )
| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C | Cl-Cl |
| 键能/kJ•mol-1 | 460 | 360 | 436 | 431 | 176 | 347 | 243 |
| A. | 表中最稳定的共价键是Si-Si | |
| B. | Cl2(g)→2 Cl(g):△H=-243 kJ•mol | |
| C. | H2 (g)+Cl2(g)=2HCl(g):△H=-183 kJ•mol | |
| D. | 根据表中数据能计算出SiCl4(g)+2 H2(g)=Si(s)+4 HCl(1)的△H |
16.在周期表中,下列各组元素位于同主族的是( )
| A. | Mg、Al | B. | Se,Br | C. | Si、Ge | D. | S、As |
13.在下列物质中:①Al ②NaHCO3 ③Al2O3 ④(NH4)2S ⑤SiO2 ⑥Al(OH)3⑦AgNO3 ⑧Na2CO3既能和盐酸反应,又能后NaOH溶液反应的是( )
| A. | ①②③⑥ | B. | ①③④⑤⑧ | C. | ①②③④⑥⑦ | D. | 全部 |
10.下列比较中正确的是( )
①沸点:乙烷<乙醇 ②沸点:正戊烷>异戊烷 ③相对密度:1-丁烯>1-庚烯.
①沸点:乙烷<乙醇 ②沸点:正戊烷>异戊烷 ③相对密度:1-丁烯>1-庚烯.
| A. | ①② | B. | ②③ | C. | ①③ | D. | ①②③ |
17.如表是A、B、C、D、E五种有机物的有关信息;
根据表中信息回答下列问题:
(1)A与溴的四氯化碳溶液反应的生成物的名称叫做1,2-二溴乙烷;写出在一定条件下,A生成高分子化合物的化学反应方程式 .
.
(2)A与氢气发生加成反应后生成分子F,F在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2.当n=4时,这类有机物开始出现同分异构体.
(3)B具有的性质是②③(填号):①无色无味液体、②有毒、③不溶于水、④密度比水大、⑤与酸性KMnO4溶液和溴水反应褪色、⑥任何条件下不与氢气反应;写出在浓硫酸作用下,B与浓硝酸反应的化学方程式: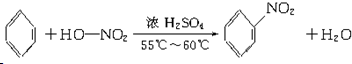 .
.
(4)C与E反应能生成相对分子质量为100的酯,其化学反应方程式为:CH2=CHCOOH+CH3CH2OH$→_{△}^{浓硫酸}$CH2=CHCOOOCH2CH3+H2O.
(5)写出由D还原生成C的化学反应方程式:CH3CHO+H2 $\stackrel{催化剂}{→}$CH3CH2OH.
| A | B | C | D | E |
| ①能使溴的四氯化碳溶液褪色; ②比例模型为:  ③能与水在一定条件下反应生成C | ①由C、H两种元素组成; ②球棍模型为:  | ①由C、H、O三种元素组成; ②能与Na反应,但不能与NaOH溶液反应; ③能与E反应生成相对分子质量为100的酯. | ①相对分子质量比C少2; ②能由C氧化而成; | ①由C、H、O三种元素组成; ②球棍模型为: 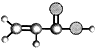 |
(1)A与溴的四氯化碳溶液反应的生成物的名称叫做1,2-二溴乙烷;写出在一定条件下,A生成高分子化合物的化学反应方程式
 .
.(2)A与氢气发生加成反应后生成分子F,F在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2.当n=4时,这类有机物开始出现同分异构体.
(3)B具有的性质是②③(填号):①无色无味液体、②有毒、③不溶于水、④密度比水大、⑤与酸性KMnO4溶液和溴水反应褪色、⑥任何条件下不与氢气反应;写出在浓硫酸作用下,B与浓硝酸反应的化学方程式:
 .
.(4)C与E反应能生成相对分子质量为100的酯,其化学反应方程式为:CH2=CHCOOH+CH3CH2OH$→_{△}^{浓硫酸}$CH2=CHCOOOCH2CH3+H2O.
(5)写出由D还原生成C的化学反应方程式:CH3CHO+H2 $\stackrel{催化剂}{→}$CH3CH2OH.
14.几种短周期元素的原子半径及主要化合价如表:
下列叙述不正确的是( )
| 元素代号 | X | Y | Z | W | V |
| 原子半径/nm | 0.090 | 0.118 | 0.075 | 0.073 | 0.102 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 | +6、-2 |
| A. | X、Z、W位于同周期,Y与V位于同周期 | |
| B. | Y3+与V2-的核外电子数相等 | |
| C. | Y与W形成的化合物具有两性 | |
| D. | Z的氢化物可与V的最高价氧化物的水溶液反应生成盐 |
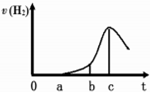 某兴趣小组进行“活泼金属与酸反应”的实验.将5.4g的铝片投入500mL0.5mol•L-1的硫酸溶液中,下图为反应产生氢气速率与反应时间的关系图.
某兴趣小组进行“活泼金属与酸反应”的实验.将5.4g的铝片投入500mL0.5mol•L-1的硫酸溶液中,下图为反应产生氢气速率与反应时间的关系图.