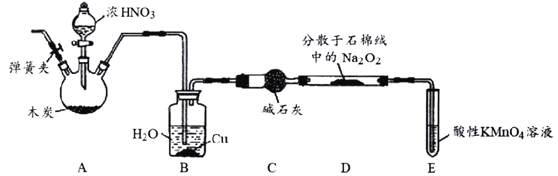
题目内容
【题目】0.1 mol·L-1的氨水10mL,加蒸馏水稀释到1L后,下列变化中正确的是( )
①NH3·H2O电离程度增大 ②c(NH3·H2O)增大 ③NH4+数目增多 ④c(OH-)增大
⑤溶液导电能力增强 ⑥![]() 增大
增大
A. ①⑤⑥ B. ②③④ C. ①③⑥ D. ③⑤⑥
【答案】C
【解析】
①因加水促进弱电解质的电离,则氨水的电离程度增大,故①正确;②加水时电离平衡正向移动,n(NH3H2O)减小,且溶液的体积变大,则c(NH3H2O)减小,故②错误;③加水时电离平衡正向移动,n(NH4+)增大,由N=n×NA,则NH4+数目增多,故③正确;④加水稀释,溶液的碱性减弱,则c(OH-)减小,故④错误;⑤加水稀释时,溶液中的离子的浓度减小,则导电性减弱,故⑤错误;⑥加水时电离平衡正向移动,n(NH4+)增大,n(NH3H2O)减小,在同一溶液中体积相同,离子的浓度之比等于物质的量之比,则![]() 增大,故⑥正确;正确的有①③⑥,故选C。
增大,故⑥正确;正确的有①③⑥,故选C。

 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案【题目】在10 L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g) ![]() M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:
实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | ||
n(X) | n(Y) | n(M) | |||
① | 700 | 0.40 | 0.10 | 0.090 | |
② | 800 | 0.10 | 0.40 | 0.080 | |
③ | 800 | 0.20 | 0.30 | a | |
④ | 900 | 0.10 | 0.15 | b | |
下列说法正确的是( )
A. 实验①中,若5 min时测得n(M)=0.050 mol,则0至5 min时间内,用N表示的平均反应速率v(N)=1.0×10-2 mol·L-1·min-1
B. 实验②中,该反应的平衡常数K=2.0
C. 实验③中,达到平衡时,X的转化率为60%
D. 实验④中,达到平衡时,b>0.060
【题目】在298 K时,实验测得溶液中的反应:H2O2+2HI===2H2O+I2,在不同浓度时的化学反应速率见下表,由此可推知当c(HI)=0.500 mol·L-1,c(H2O2)=0.400 mol·L-1时的反应速率为( )
实验编号 | 1 | 2 | 3 | 4 | 5 |
c(HI)/mol·L-1 | 0.100 | 0.200 | 0.300 | 0.100 | 0.100 |
c(H2O2)/mol·L-1 | 0.100 | 0.100 | 0.100 | 0.200 | 0.300 |
v/mol·L-1·s-1 | 0.007 60 | 0.015 3 | 0.022 7 | 0.015 1 | 0.022 8 |
A. 0.152 mol·L-1·s-1 B. 0.038 0 mol·L-1·s-1
C. 0.608 mol·L-1·s-1 D. 0.760 mol·L-1·s-1