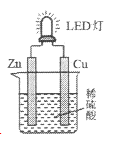
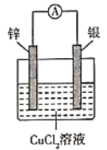
题目内容
【题目】A(C3H6)是基本有机化工原料。由A制备聚合物C和![]() 的合成路线(部分反应条件略去)如图所示:
的合成路线(部分反应条件略去)如图所示:
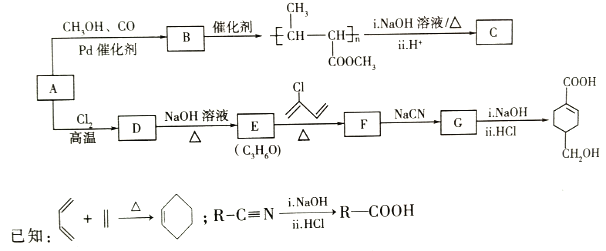
回答下列问题:
(1)D的名称是_______,B含有的含氧官能团的名称是_______________。
(2)C的结构简式为_______________,D→E的反应类型为________________。
(3)E→F的化学方程式为____________________________。
(4)![]() 中最多有__________个原子共平面,
中最多有__________个原子共平面,![]() 发生缩聚反应生成有机物的结构简式为_______________。
发生缩聚反应生成有机物的结构简式为_______________。
(5)B的同分异构体中,与B具有相同的官能团且能发生银镜反应的共有________种;其中核磁共振氢谱为3组峰,且峰面积之比为6:1:1的是__________(写结构简式)。
(6)结合题给信息,以乙烯、HBr为起始原料制备丙酸,设计合成路线。(无机试剂任选,合成路线流程图示例见本题题干) ________________
【答案】3-氯丙烯 酯基  取代反应或水解反应
取代反应或水解反应  10
10 ![]() 8
8 ![]()
![]()
【解析】
分析流程图:由高聚物![]() 结构特点可推知,该高聚物是由B通过加聚反应得到的,因此B的结构简式为CH3CH=CHCOOCH3。高聚物
结构特点可推知,该高聚物是由B通过加聚反应得到的,因此B的结构简式为CH3CH=CHCOOCH3。高聚物![]() 结构中含有酯基,在NaOH溶液中共热发生酯的水解反应,再酸化生成羧基,故C的结构简式为
结构中含有酯基,在NaOH溶液中共热发生酯的水解反应,再酸化生成羧基,故C的结构简式为![]() 。运用逆合成分析法思考,由G
。运用逆合成分析法思考,由G![]()
![]() 符合“已知”信息中-CN转化为-COOH的过程,可推知G为
符合“已知”信息中-CN转化为-COOH的过程,可推知G为![]() ,E转化为F符合“已知”信息中烯烃环加成,故F为
,E转化为F符合“已知”信息中烯烃环加成,故F为![]() ,E为CH2=CHCH2OH。D是A与Cl2的反应产物,D又能在NaOH水溶液共热转化为CH2=CHCH2OH,该过程应为卤代烃水解反应生成醇羟基,所以D为CH2=CHCH2Cl,可得A的结构简式为CH2=CHCH3。
,E为CH2=CHCH2OH。D是A与Cl2的反应产物,D又能在NaOH水溶液共热转化为CH2=CHCH2OH,该过程应为卤代烃水解反应生成醇羟基,所以D为CH2=CHCH2Cl,可得A的结构简式为CH2=CHCH3。
(1) D是A(C3H6)与Cl2的反应产物,D又能在NaOH水溶液共热转化为CH2=CHCH2OH,该过程为卤代烃水解反应生成醇羟基,所以D的结构简式CH2=CHCH2Cl,用系统命名法给该有机物命名为:3-氯丙烯。由高聚物![]() 结构特点可推知B的结构简式为CH3CH=CHCOOCH3,B含有的含氧官能团的名称是酯基。
结构特点可推知B的结构简式为CH3CH=CHCOOCH3,B含有的含氧官能团的名称是酯基。
(2)由于高聚物![]() 在NaOH溶液中共热发生酯的水解反应,再酸化生成羧基,则C的结构简式为
在NaOH溶液中共热发生酯的水解反应,再酸化生成羧基,则C的结构简式为![]() 。D的结构简式为CH2=CHCH2Cl,D分子中含有氯原子,在NaOH溶液中共热发生水解反应生成E(CH2=CHCH2OH),所以D→E的反应类型为水解反应或取代反应。
。D的结构简式为CH2=CHCH2Cl,D分子中含有氯原子,在NaOH溶液中共热发生水解反应生成E(CH2=CHCH2OH),所以D→E的反应类型为水解反应或取代反应。
(3) E为CH2=CHCH2OH,F为![]() ,E转化为F符合“已知”信息中烯烃环加成过程,其化学反应方程式为
,E转化为F符合“已知”信息中烯烃环加成过程,其化学反应方程式为 。
。
(4) ![]() 分子中含有2个通过C-C连接的
分子中含有2个通过C-C连接的![]() 结构,两个
结构,两个![]() 的平面通过单键旋转而共平面,所以该分子中所有原子可能处于同一平面上,所以最多共有10个原子共平面。
的平面通过单键旋转而共平面,所以该分子中所有原子可能处于同一平面上,所以最多共有10个原子共平面。![]() 分子间羧基与醇羟基之间酯化脱水形成高分子,属于缩聚反应,生成高聚物的结构简式为
分子间羧基与醇羟基之间酯化脱水形成高分子,属于缩聚反应,生成高聚物的结构简式为![]() 。
。
(5) B的结构简式为CH3CH=CHCOOCH3,分子式为C5H8O2,B分子含有碳碳双键和酯基官能团,酯类有机物中只有甲酸酯类物质能发生银镜反应,故同分异构体结构中含有HCOO-。其同分异构体有HCOOCH=CHCH2CH3、HCOOCH2CH=CHCH3、HCOOCH2CH2CH=CH2、HCOOC(CH3)=CHCH3、HCOOCH(CH3)CH=CH2、HCOOC(CH2CH3)=CH2、HCOOCH=C(CH3)2、HCOOCH2C(CH3)=CH2,共8种。其中核磁共振氢谱为3组峰,且峰面积之比为6:1:1的结构简式为HCOOCH=C(CH3)2。
(6)目的产物丙酸CH3CH2COOH分子比原料乙烯分子少一个碳原子,依据本题信息可由R-CN![]() R-COOH增加碳原子,根据流程图中F
R-COOH增加碳原子,根据流程图中F![]() G的反应,可推知R-CN可由R-Br取代得到。其合成路线如下:CH2=CH2
G的反应,可推知R-CN可由R-Br取代得到。其合成路线如下:CH2=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2CN
CH3CH2CN![]() CH3CH2COOH。
CH3CH2COOH。

【题目】以NaCl为主要成分的融雪剂会腐蚀桥梁、铁轨等钢铁设备。某研究小组探究NaCl溶液对钢铁腐蚀的影响。
(1)将滤纸用3.5%的NaCl溶液润湿,涂上铁粉、碳粉的混合物,贴在表面皿上。在滤纸上加几滴检验试剂,再缓慢加入NaCl溶液至没过滤纸,操作如下所示:

①实验ⅰ的现象说明,得电子的物质是_______________________________。
②碳粉的作用是___________________________________________________。
③为了说明NaCl的作用,需要补充的对照实验是_____________________。
(2)向如图示装置的烧杯a、b中各加入30mL 3.5%的NaCl溶液,闭合K,指针未发生偏转。加热烧杯a,指针向右偏转。

①取a、b中溶液少量,滴加K3[Fe(CN)6]溶液,a中出现蓝色沉淀,b中无变化,b中铁片作________极。
②加热后,指针发生偏转的原因可能是_____________________。
(3)用(2)中图示装置探究不同浓度NaCl溶液对钢铁腐蚀的影响,向烧杯a、b中各加入30mL不同质量分数的NaCl溶液,实验记录如下表所示。
实验 | a | b | 指针偏转方向 |
I | 0.1% | 0.01% | 向右 |
II | 0.1% | 3.5% | 向左 |
Ⅲ | 3.5% | 饱和溶液 | 向右 |
①Ⅱ中,b中电极发生的电极反应式是_______________________________。
②Ⅲ中,铁在饱和NaCl溶液中不易被腐蚀。查阅资料可知:在饱和NaCl溶液中O2浓度较低,钢铁不易被腐蚀。设计实验证明:_______________________________。
(4)根据上述实验,对钢铁腐蚀有影响的因素是_______________________________。