题目内容
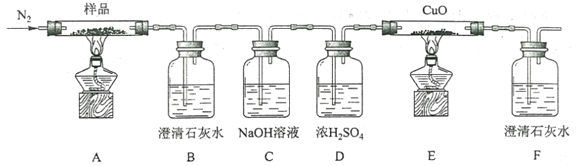
【题目】下图是课外活动小组设计的用化学电源使LED灯发光的装置。下列说法正确的是

A. 溶液中的SO42-向铜极移动
B. 锌片为原电池的负极,发生还原反应
C. 如果将稀硫酸换成柠檬汁,导线中不会有电子流动
D. 铜片表面有气泡生成,发生的反应为:2H++2e-=H2↑
【答案】D
【解析】
Zn、Cu、硫酸构成的原电池金属锌做负极,金属铜做正极。
A、原电池中阳离子移向正极,阴离子移向负极,溶液中的SO42-移向负极锌极,选项A错误;
B、Zn、Cu、硫酸构成的原电池锌片为原电池的负极,发生氧化反应,选项B错误;
C、如果将稀硫酸换成柠檬汁,也能形成原电池,导线中有电子流动,选项C错误;
D、金属铜做正极,正极上放电的是氢离子,有氢气逸出,发生的反应为:2H++2e-=H2↑,选项D正确。
答案选D。

【题目】CO2是一种廉价的碳资源,其综合利用具有重要意义。回答下列问题:
(1)CO2可以被NaOH溶液捕获。若所得溶液pH=13,CO2主要转化为______(写离子符号);若所得溶液c(HCO3)∶c(CO32)=2∶1,溶液pH=___________。(室温下,H2CO3的K1=4×107;K2=5×1011)
(2)CO2与CH4经催化重整,制得合成气:
CH4(g)+ CO2(g) ![]() 2CO (g)+ 2H2(g)
2CO (g)+ 2H2(g)
①已知上述反应中相关的化学键键能数据如下:
化学键 | C—H | C=O | H—H | C |
键能/kJ·mol1 | 413 | 745 | 436 | 1075 |
则该反应的ΔH=_________。分别在VL恒温密闭容器A(恒容)、B(恒压,容积可变)中,加入CH4和CO2各1 mol的混合气体。两容器中反应达平衡后放出或吸收的热量较多的是_______(填“A” 或“B ”)。
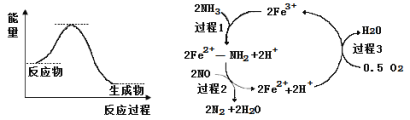
②按一定体积比加入CH4和CO2,在恒压下发生反应,温度对CO和H2产率的影响如图3所示。此反应优选温度为900℃的原因是________。
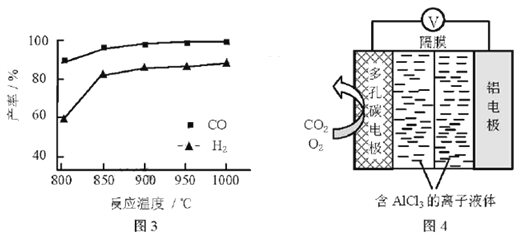
(3)O2辅助的Al~CO2电池工作原理如图4所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。
电池的负极反应式:________。
电池的正极反应式:6O2+6e![]() 6O2
6O2
6CO2+6O2![]() 3C2O42
3C2O42
反应过程中O2的作用是________。
该电池的总反应式:________。
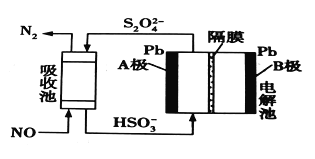
【题目】目前汽车尾气中的NO处理有以下几种方法:
(1)在汽车排气管上安装催化转化器。NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生反应:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) △H 。
N2(g)+2CO2(g) △H 。
①已知:N2(g)+O2(g)=2NO(g)△H1=+180.5kJ·mol-1,C(s)+O2(g)=CO2(g) △H2=-393.5 kJ·mol-1,2C(s)+O2(g)=2CO(g)△H3=-221kJ·mol-1,则△H=______。
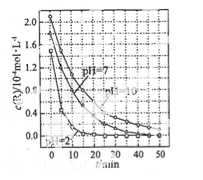
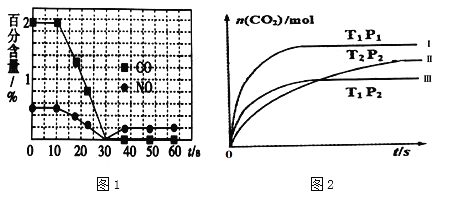
②一个兴趣小组对某汽车冷启动时的尾气催化处理过程中CO、NO百分含量随时间变化如图1所示,前0﹣10s 阶段,CO、NO百分含量没明显变化的原因是_____________________。同时该小组在固定容积为2L的密闭容器中通入NO和CO各2mol进行反应,n(CO2)随温度(T)、压强(P)和时间(t)的变化曲线如图2所示,图中的曲线Ⅰ、Ⅱ、Ⅲ对应反应从开始到平衡时用CO2表示的平均反应速率分别为v(Ⅰ)、v(Ⅱ)、v(Ⅲ),则三者大小关系为______________。
(2)活性炭也可用于处理汽车尾气中的NO。在1L恒容密闭容器中加入0.1000molNO和2.030mol固体活性炭,生成CO2、N2两种气体,在不同温度下测得平衡体系中各物质的物质的量以及容器内压强如下表:
活性炭/mol | NO/mol | CO2/mol | N2/mol | P/MPa | |
200℃ | 2.000 | 0.0400 | 0.0300 | 0.0300 | 3.93 |
X | 2.005 | 0.0500 | 0.0250 | 0.0250 | 4.56 |
容器中发生反应的化学方程式为C(s) +2NO(g) CO2(g) +N2(g);根据上表数据,并判断X_____200℃(用“>”、“<“或“=”填空),计算反应体系在200℃时的平衡常数Kp=_____(用平衡分压代替平衡浓度计算,分压=总压×体积分数)。
(3)用间接电化学法除去NO的过程,如图所示。已知电解池的阴极室中溶液的pH在4~7之间,B极为_________(填“阳极”或“阴极”);写出A极的电极反应式:____________。