题目内容
【题目】有机物A仅含有C、H、O三种元素,可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
限选试剂:蒸馏水、2 mol·L-1盐酸溶液、2 mol·L-1NaOH溶液、浓硫酸、NaHCO3粉末、金属Na、无水乙醇
实验步骤 | 实验结论 |
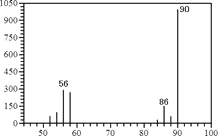
(1)A的质谱图如下: | (1)证明A的相对分子质量为:__________。 |
(2)将此9.0 g A在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现分别增重5.4 g和13.2 g。 | (2)证明A的分子式为: ________________。 |
(3)另取两份9.0 g A分置于不同的试管中。往其中一份A中加入足量的NaHCO3粉末充分反应,生成_______ L CO2(标准状况)。 往另一份A中加入足量的金属钠充分反应,生成________________________ L H2(标准状况)。 | (3)证明A的分子中含有一个羧基和一个羟基。 |
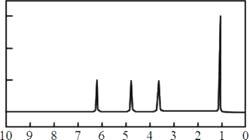
(4)A的核磁共振氢谱如下图: | (4)A的结构简式为: __________________。 |
【答案】90 C3H6O3 2.24 2.24 ![]()
【解析】
(1)根据质谱图可知,该有机物的相对分子质量为90。
(2)产物依次缓缓通过浓硫酸、碱石灰,发现分别增重5.4 g和13.2 g,这说明生成的水是5.4g、CO2是13.2g。其中水的物质的量是5.4g÷18g/mol=0.3mol,含有氢原子的物质的量是0.6mol;CO2的物质的量是13.2g÷44g/mol=0.3mol,碳原子的物质的量是0.3mol。9.0gA的物质的量是9.0g÷90g/mol=0.1mol,所以根据原子守恒可知,A分子中含有3个碳原子和6个氢原子。则含有的氧原子个数是![]() 个,所以该有机物的化学式是C3H6O3。
个,所以该有机物的化学式是C3H6O3。
(3)A分子中含有1个羧基,所以0.1molA跟足量的NaHCO3粉末反应,生成0.1mol CO2,在标准状况下的体积是0.1mol×22.4L/mol=2.24L;A中还含有1个羟基,则0.1molA和足量的金属钠反应可以生成0.1mol氢气,在标准状况下的体积是0.1mol×22.4L/mol=2.24L。
(4)根据A的核磁共振氢谱可知,分子中含有4类氢原子,所以A的结构简式是![]() 。
。

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案【题目】如表所示有关物质检验的实验结论正确的是( )
选项 | 实验操作及现象 | 实验结论 |
A | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有 |
B | 向某溶液中加入盐酸,将生成的气体通入品红溶液中,品红溶液褪色 | 该溶液一定含有 |
C | 将SO2通入Na2CO3溶液中生成的气体,先通入足量的酸性KMnO4溶液,再通入澄清石灰水中有浑浊 | 说明酸性:H2SO3>H2CO3 |
D | 将某气体通入品红溶液中,品红溶液褪色 | 该气体一定是SO2 |
A.AB.BC.CD.D
【题目】某地菱锰矿的主要成分为MnCO3,还含有少量的FeCO3、CaCO3、Al2O3等杂质。工业上以菱锰矿为原料制备高纯度碳酸锰的流程如图所示:
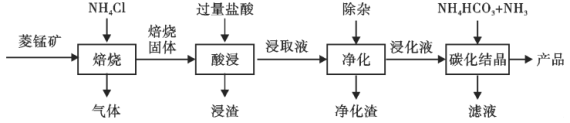
已知:MnCO3+2NH4Cl=MnCl2+CO2↑+2NH3↑+H2O.
相关金属离子[c0(Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 |
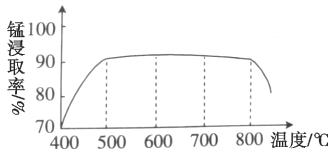
(1)焙烧时温度对锰浸取率的影响如图。焙烧时适宜的温度为___________左右;800℃以上锰的浸取率偏低,可能的原因是___________。
(2)净化包含三步:①加入少量MnO2,添加少量MnO2的作用是____________。发生反应的离子方程式为___________。
②加氨水调pH,溶液的pH范围应调节为___________~8.1之间。生成的沉淀主要是___________。
③加入MnF2,沉淀除去Ca2+,若溶液酸度过高,Ca2+沉淀不完全,原因是___________。
(3)碳化结晶中生成MnCO3的离子方程式为____________。