题目内容
【题目】在一定条件下的反应:3H2 (g)+N2 (g) ![]() NH3 (g),达到限度的标志是( )
NH3 (g),达到限度的标志是( )
A.H2、N2、NH3的分子个数之比为3:1:2B.N2的正反应速率和逆反应速率相等
C.反应已经停止D.单位时间内生成3mol H2,同时生成1mol N2
【答案】B
【解析】
A.当体系达平衡状态时,N2、H2、NH3分子数之比为1:3:2,也可能不是1:3:2,与各物质的初始浓度及转化率有关,故A错误;
B.当体系达平衡状态时,N2、H2、NH3的浓度不再变化,说明氮气的正逆反应速率相等,故B正确;
C.达到平衡状态,正逆反应速率相等,反应仍在进行,所以正、逆反应速率不等于零,反应不停止,故C错误;
D.在反应进行的任一时刻,单位时间内生成3mol H2,同时生成1mol N2,速率方向同向,不能说明反应达到平衡状态,故D错误;
答案选B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】有机物A仅含有C、H、O三种元素,可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
限选试剂:蒸馏水、2 mol·L-1盐酸溶液、2 mol·L-1NaOH溶液、浓硫酸、NaHCO3粉末、金属Na、无水乙醇
实验步骤 | 实验结论 |
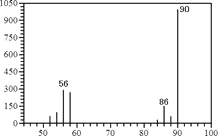
(1)A的质谱图如下: | (1)证明A的相对分子质量为:__________。 |
(2)将此9.0 g A在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现分别增重5.4 g和13.2 g。 | (2)证明A的分子式为: ________________。 |
(3)另取两份9.0 g A分置于不同的试管中。往其中一份A中加入足量的NaHCO3粉末充分反应,生成_______ L CO2(标准状况)。 往另一份A中加入足量的金属钠充分反应,生成________________________ L H2(标准状况)。 | (3)证明A的分子中含有一个羧基和一个羟基。 |
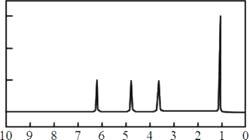
(4)A的核磁共振氢谱如下图: | (4)A的结构简式为: __________________。 |