题目内容
【题目】取一定量硫酸亚铁和硫酸铁混合物样品溶于水,配成100mL溶液。所得溶液分成二份,在第一份溶液中加入0.5mol·L-1氯化钡220mL恰好完全反应;在第二份溶液中通入标准状况下的氯气0.896L,可使Fe2+全部变成Fe3+。
(1)所取样品中硫酸亚铁物质的量是___。
(2)在第一份溶液完全反应后的溶液中再加入足量氢氧化钠溶液,所得沉淀经洗涤后,在空气中充分灼烧,得到残渣的质量是___。
【答案】0.16mol 8g
【解析】
(1) 第二份溶液中通入标准状况下的氯气0.896L,发生反应2Fe2++Cl2=2Fe3++2Cl-,以此计算亚铁离子的物质的量;
(2) 加入氯化钡溶液,发生反应:Ba2++![]() -=BaSO4↓,用钡离子的物质的量计算第一份溶液中的硫酸根离子的物质的量,进而求得物质硫酸铁的物质的量,加入NaOH溶液后,在空气中充分灼烧,得到的残渣为Fe2O3,由铁原子守恒求得质量。
-=BaSO4↓,用钡离子的物质的量计算第一份溶液中的硫酸根离子的物质的量,进而求得物质硫酸铁的物质的量,加入NaOH溶液后,在空气中充分灼烧,得到的残渣为Fe2O3,由铁原子守恒求得质量。
(1)在第二份溶液中通入标准状况下的氯气0.896L,发生反应2Fe2++Cl2=2Fe3++2Cl-,![]() ,因所取样品配成溶液分成二份,则样品中硫酸亚铁物质的量是
,因所取样品配成溶液分成二份,则样品中硫酸亚铁物质的量是![]() ,故答案为0.16mol;
,故答案为0.16mol;
(2)在第一份溶液中加入0.5molLˉ1氯化钡溶液220mL,发生反应:Ba2++![]() -=BaSO4↓,
-=BaSO4↓,![]() ,则Fe2(SO4)3中的n(
,则Fe2(SO4)3中的n(![]() )=0.11mol-0.08mol=0.03mol,
)=0.11mol-0.08mol=0.03mol,![]() ,
,![]() ,每份溶液中含有Fe2+和Fe3+的物质的量分别为0.08mol和0.02mol,在第一份溶液完全反应后所得溶液中再加入足量氢氧化钠溶液,所得沉淀经洗涤,在空气中充分灼烧,得到的残渣为Fe2O3,根据铁原子守恒可知:
,每份溶液中含有Fe2+和Fe3+的物质的量分别为0.08mol和0.02mol,在第一份溶液完全反应后所得溶液中再加入足量氢氧化钠溶液,所得沉淀经洗涤,在空气中充分灼烧,得到的残渣为Fe2O3,根据铁原子守恒可知:![]() ,
,![]() ,故答案为8g。
,故答案为8g。

【题目】随着科学技术的发展和环保要求的不断提高,CO2的捕集利用技术成为研究的重点。
完成下列填空:
(1)目前国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:
CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
已知H2的体积分数随温度升高而增加。
若温度从300℃升至400℃,重新达到平衡,判断下列表格中各物理量的变化。(选填“增大”、“减小”或“不变”)
v正 | v逆 | 平衡常数K | 转化率α |
(2)相同温度时,上述反应在不同起始浓度下分别达到平衡,各物质的平衡浓度如下表:
[CO2]/mol·L-1 | [H2]/mol·L-1 | [CH4]/mol·L-1 | [H2O]/mol·L-1 | |
平衡Ⅰ | a | b | c | d |
平衡Ⅱ | m | n | x | y |
a、b、c、d与m、n、x、y之间的关系式为_________。
(3)碳酸:H2CO3,Ki1=4.3×10-7,Ki2=5.6×10-11
草酸:H2C2O4,Ki1=5.9×10-2,Ki2=6.4×10-5
0.1 mol/L Na2CO3溶液的pH____________0.1 mol/L Na2C2O4溶液的pH。(选填“大于”、“小于”或“等于”)
等浓度的草酸溶液和碳酸溶液中,氢离子浓度较大的是___________。
若将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子浓度大小的顺序正确的是_____。(选填编号)
a.[H+]>[HC2O4-]>[HCO3-]>[CO32-]
B.[HCO3-]>[HC2O4-]>[C2O42-]>[CO32-]
c.[H+]>[HC2O4-]>[C2O42-]>[CO32-]
D.[H2CO3] >[HCO3-]>[HC2O4-]>[CO32-]
(4)人体血液中的碳酸和碳酸氢盐存在平衡:H++ HCO3-![]() H2CO3,当有少量酸性或碱性物质进入血液中时,血液的pH变化不大,用平衡移动原理解释上述现象。
H2CO3,当有少量酸性或碱性物质进入血液中时,血液的pH变化不大,用平衡移动原理解释上述现象。
____________________________________________________________________________________
【题目】已知K2Cr2O7溶液中存在平衡:Cr2O72-+H2O ![]() 2CrO42-+2H+。K2Cr2O7为橙色,K 2CrO4为黄色。为探究浓度对化学平衡的影响,某兴趣小组设计了如下实验方案。
2CrO42-+2H+。K2Cr2O7为橙色,K 2CrO4为黄色。为探究浓度对化学平衡的影响,某兴趣小组设计了如下实验方案。
| 序号 | 试剂X |
ⅰ | 1 mL1mol·L-1 K2Cr2O7 溶液 | |
ⅱ | 1mL1 mol·L-1 K2CrO4溶液 | |
ⅲ | 5~15滴浓硫酸 | |
ⅳ | 5~15滴浓盐酸 | |
ⅴ | 5~15滴6 mol·L-1 NaOH溶液 |
Ⅰ.方案讨论
(1)ⅰ~ⅴ中依据减少生成物浓度可导致平衡移动的原理设计的是______(填序号)。
(2)已知BaCrO4为黄色沉淀。某同学认为试剂X还可设计为Ba(NO3)2溶液,加入该试剂后,溶液颜色将_____。(填“变深”、“变浅”或“不变”)。
Ⅱ.实验分析
序号 | 试剂X | 预期现象 | 实际现象 |
ⅰ | 1 mL1 mol·L-1 K2Cr2O7 溶液 | 溶液变黄 | 溶液橙色加深 |
ⅱ | 1mL1 mol·L-1 K2CrO4溶液 | 溶液橙色加深 | 溶液颜色变浅 |
ⅲ | 5~15滴浓硫酸 | 溶液橙色加深 | 溶液橙色加深 |
ⅳ | 5~15滴浓盐酸 | 溶液橙色加深 | 无明显现象 |
ⅴ | 5~15滴6mol·L-1NaOH溶液 | 溶液变黄 | 溶液变黄 |
(1)实验ⅰ没有观察到预期现象的原因是____________,实验ⅱ的原因与其相似。
(2)通过实验ⅲ和ⅴ得出的结论为___________ 。
(3)实验ⅳ无明显现象,可能的原因是____________。
(4)某同学查阅资料发现:K2Cr2O7溶液与浓盐酸可发生氧化还原反应。但实验ⅳ中没有观察到明显现象,小组同学设计了两个实验,验证了该反应的发生。
① 方案一:取5 mL浓盐酸,向其中加入15滴0.1mol·L-1 K2Cr2O7溶液,一段时间后,溶液变为绿色(CrCl3水溶液呈绿色),有黄绿色气体生成。写出该变化的化学方程式__________。
② 请你设计方案二:_______________。
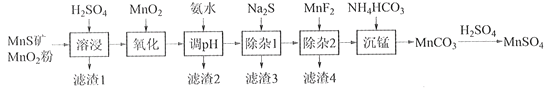
【题目】高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
相关金属离子[c0(Mn+)=0.1 mol·L1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有S和__________________________;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式____________________________________________________。
(2)“氧化”中添加适量的MnO2的作用是将________________________。
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______~6之间。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是______________。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是_____________________________________________________________________。
(6)写出“沉锰”的离子方程式___________________________________________________。
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnz2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y=![]() 时,z=___________。
时,z=___________。
【题目】有机物A仅含有C、H、O三种元素,可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
限选试剂:蒸馏水、2 mol·L-1盐酸溶液、2 mol·L-1NaOH溶液、浓硫酸、NaHCO3粉末、金属Na、无水乙醇
实验步骤 | 实验结论 |
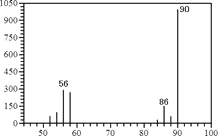
(1)A的质谱图如下: | (1)证明A的相对分子质量为:__________。 |
(2)将此9.0 g A在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现分别增重5.4 g和13.2 g。 | (2)证明A的分子式为: ________________。 |
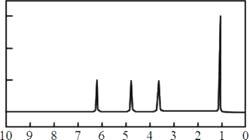
(3)另取两份9.0 g A分置于不同的试管中。往其中一份A中加入足量的NaHCO3粉末充分反应,生成_______ L CO2(标准状况)。 往另一份A中加入足量的金属钠充分反应,生成________________________ L H2(标准状况)。 | (3)证明A的分子中含有一个羧基和一个羟基。 |
(4)A的核磁共振氢谱如下图: | (4)A的结构简式为: __________________。 |