题目内容
【题目】![]() 是原子序数依次增大的短周期主族元素,
是原子序数依次增大的短周期主族元素,![]() 在氧气中燃烧生成淡黄色固体。
在氧气中燃烧生成淡黄色固体。![]() 与其它四种元素不同周期,
与其它四种元素不同周期,![]() 相邻。
相邻。![]() 的最外层电子数是
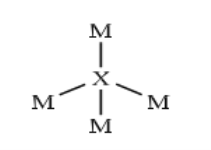
的最外层电子数是![]() 次外层电子数的一半,两者形成的化合物结构如图所示。下列说法错误的是( )
次外层电子数的一半,两者形成的化合物结构如图所示。下列说法错误的是( )
A.气态氢化物稳定性:![]()
B.简单离子半径:![]()
C.![]() 的氧化物可能均具有漂白性
的氧化物可能均具有漂白性
D.Y分别与![]() 形成的二元化合物均含离子键
形成的二元化合物均含离子键
【答案】B
【解析】
![]() 在氧气中燃烧生成淡黄色固体,淡黄色固体为Na2O2,
在氧气中燃烧生成淡黄色固体,淡黄色固体为Na2O2,![]() 为Na,由图可知,
为Na,由图可知,![]() 能形成四个键,
能形成四个键,![]() 能形成一个键,且
能形成一个键,且![]() 的最外层电子数是
的最外层电子数是![]() 次外层电子数的一半,
次外层电子数的一半,![]() 为C,
为C,![]() 为Cl,
为Cl, ![]() 相邻,
相邻,![]() 为S,
为S,![]() 与其它四种元素不同周期,
与其它四种元素不同周期,![]() 为H。
为H。
A. ![]() 为Cl,
为Cl,![]() 为S,其气态氢化物分别为HCl,H2S,其稳定性: HCl>H2S,A正确;
为S,其气态氢化物分别为HCl,H2S,其稳定性: HCl>H2S,A正确;
B. ![]() 为Na,
为Na,![]() 为S, 简单离子分别为Na+,S2-,其半径:r(Na+)<r(S2-),B错误;
为S, 简单离子分别为Na+,S2-,其半径:r(Na+)<r(S2-),B错误;
C. ![]() 为S,
为S,![]() 为H ,其氧化物中,SO2、H2O2,均具有漂白性,C正确;
为H ,其氧化物中,SO2、H2O2,均具有漂白性,C正确;
D. ![]() 为Na,
为Na,![]() 为H,
为H,![]() 为Cl, Na与H形成NaH,Na与Cl形成NaCl,都是离子化合物,D正确;故答案为:B。
为Cl, Na与H形成NaH,Na与Cl形成NaCl,都是离子化合物,D正确;故答案为:B。

 轻松暑假总复习系列答案
轻松暑假总复习系列答案【题目】用活性炭还原处理氮氧化物,有关反应为C(s)+2NO(g) ![]() N2(g)+CO2(g)。
N2(g)+CO2(g)。
(1)写出上述反应的平衡常数表达式_______________。
(2)在2L恒容密闭器中加入足量C与NO发生反应,所得数据如表,回答下列问题。
实验编号 | 温度/℃ | 起始时NO的物质的量/mol | 平衡时N2的物质的量/mol |
1 | 700 | 0.40 | 0.09 |
2 | 800 | 0.24 | 0.08 |
①结合表中数据,判断该反应的△H____0(填“>”或“<”),理由是_________。
②判断该反应达到平衡的依据是_______。
A.容器内气体密度恒定 B.容器内各气体浓度恒定
C.容器内压强恒定 D.2v正(NO)= v逆(N2)
(3)700℃时,若向2L体积恒定的密闭容器中充入一定量N2和CO2发生反应:N2(g)+CO2(g)![]() C(s)+2NO(g) ;其中N2、NO物质的量随时间变化的曲线如下图所示。请回答下列问题。
C(s)+2NO(g) ;其中N2、NO物质的量随时间变化的曲线如下图所示。请回答下列问题。
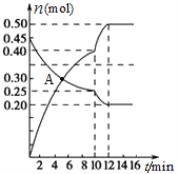
①0~10 min内的CO2平均反应速率v=____________。
②图中A点v(正)___v(逆)(填“>”、“<”或“=”)。
③第10 min时,外界改变的条件可能是_____________。
A.加催化剂 B.增大C的物质的量
C.减小CO2的物质的量 D.升温 E.降温
【题目】滴定法是解决化学分析问题的常用方法。滴定的方法有酸碱中和滴定、氧化还原滴定、沉淀滴定、络合滴定等。
I.如图为某浓度的NaOH溶液滴定10.00mL一定浓度的盐酸的示意图。根据图像

(1)HCl溶液的浓度是__________;NaOH溶液的浓度是_______;
(2)x=________。
(3)若向20mL稀氨水中逐滴加入等浓度的盐酸,则下列变化趋势正确的是________(填字母)。


ΙΙ.氧化还原滴定实验与中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。
(4)人体血液里Ca2+的浓度一般采用mg/cm3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度,抽取血样20.00mL,经过上述处理后得到草酸,再用0.020mol/L KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00mL KMnO4溶液。
滴定的实验数据如下所示:
实验编号 | 待测血液的体积/mL | 滴入KMnO4溶液的体积/mL |
1 | 20.00 | 11.95 |
2 | 20.00 | 13.00 |
3 | 20.00 | 12.05 |
①滴定时,盛放高锰酸钾溶液的仪器名称为_________确定反应达到终点的现象_____________。
②草酸跟酸性KMnO4溶液反应的离子方程式为:2MnO42-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O,根据所给数据计算血液样品中Ca2+离子的浓度为__________mg/cm3
【题目】以低品位红土镍矿(主要成分可表示为![]() 、
、![]() 、
、![]() ,含有少量
,含有少量![]() 、
、![]() 、
、![]() 、
、![]() )为原料制备纳米级
)为原料制备纳米级![]() 的工艺流程如下:
的工艺流程如下:

已知氢氧化物的参数如下表:
氢氧化物 | 溶度积 | 开始沉淀 | 完全沉淀 |
|
| 4.1 | 5.5 |
|
| 2.2 | 3.5 |
|
| 6.7 | 9.5 |
|
| 9.4 | 12.4 |
回答下列问题:
(1)“滤渣Ⅰ”的主要成分是______(填化学式)。
(2)常温下,调![]() 的目的是______。当
的目的是______。当![]() 时,溶液中
时,溶液中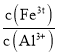 =______
=______
(3)写出“除铜镍”过程发生反应的离子方程式为![]() 、______________。“除钙”过程反应温度不宜超过
、______________。“除钙”过程反应温度不宜超过![]() 的原因_________________________。
的原因_________________________。
(4)“滤液”中溶质的主要成分为________________,获取该物质晶体的具体实验操作为__________。
【题目】在恒容条件下化学反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-QkJ·mol-1,在上述条件下分别充入的气体和反应放出的热量(Q)如表所列:
2SO3(g) ΔH=-QkJ·mol-1,在上述条件下分别充入的气体和反应放出的热量(Q)如表所列:
容器 | SO2(mol) | O2(mol) | N2(mol) | Q(kJ) |
甲 | 2 | 1 | 0 | Q1 |
乙 | 1 | 0.5 | 0 | Q2 |
丙 | 1 | 0.5 | 1 | Q3 |
根据以上数据,下列叙述正确的是( )
A.在上述条件下反应生成1molSO3固体放热![]() kJ
kJ
B.2Q1<2Q2=Q1<Q
C.Q1=2Q2=2Q3=Q
D.2Q2=2Q3<Q1<Q