题目内容
【题目】在恒容条件下化学反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-QkJ·mol-1,在上述条件下分别充入的气体和反应放出的热量(Q)如表所列:
2SO3(g) ΔH=-QkJ·mol-1,在上述条件下分别充入的气体和反应放出的热量(Q)如表所列:
容器 | SO2(mol) | O2(mol) | N2(mol) | Q(kJ) |
甲 | 2 | 1 | 0 | Q1 |
乙 | 1 | 0.5 | 0 | Q2 |
丙 | 1 | 0.5 | 1 | Q3 |
根据以上数据,下列叙述正确的是( )
A.在上述条件下反应生成1molSO3固体放热![]() kJ
kJ
B.2Q1<2Q2=Q1<Q
C.Q1=2Q2=2Q3=Q
D.2Q2=2Q3<Q1<Q
【答案】D
【解析】
2SO2(g)+O2(g)2SO3(g)△H=-QkJ/mol,反应热表示完全转化时放出的热量,固体的能量比气态能量低,生成固体时放出的热量更多;乙、丙两个容器容积相同,所充气体物质的量相同,丙中所充氮气对平衡无影响,所以乙、丙建立等效平衡,二氧化硫转化率相同,放出的热量相等;甲、乙两个容器容积相同,甲中相应物质的物质的量为乙中2倍,压强比乙中高,相对乙平衡而言甲中平衡右移,二氧化硫转化率增大,所以甲中放出的热量大于乙甲中的2倍,结合可逆反应不能完全反应判断。
A. 2SO2(g)+O2(g)2SO3(g)△H=-QkJ/mol,在上述条件下反应生成1molSO3气体放热0.5QkJ,生成1molSO3固体放出的热量大于0.5QkJ,故A错误;
B. 乙、丙两个容器容积相同,所充气体物质的量相同,丙中所充氮气对平衡无影响,所以乙、丙建立等效平衡,二氧化硫转化率相同,Q2=Q3;甲、乙两个容器容积相同,甲中相应物质的物质的量为乙中2倍,压强比乙中高,相对乙平衡而言甲中平衡右移,二氧化硫转化率增大,所以甲中放出的热量大于乙甲中的2倍,可逆反应不能完全反应,故2Q2<Q1<Q,综上所述所述,2Q2=2Q3<Q1<Q,故B错误;
C. 由B中分析可知,2Q2=2Q3<Q1<Q,故C错误;
D. 由B中分析可知,2Q2=2Q3<Q1<Q,故D正确;
故选:D。

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案【题目】科学家们致力于消除氮氧化物对大气的污染。回答下列问题:
(1)NO在空气中存在如下反应:2NO(g)+O2(g)![]() 2NO2(g) ΔH,该反应共有两步第一步反应为2NO(g)
2NO2(g) ΔH,该反应共有两步第一步反应为2NO(g)![]() N2O2(g) ΔH1<0;请写出第二步反应的热化学方程式(ΔH2用含ΔH、ΔH1的式子来表示):_______________________________________。
N2O2(g) ΔH1<0;请写出第二步反应的热化学方程式(ΔH2用含ΔH、ΔH1的式子来表示):_______________________________________。
(2)温度为T1时,在两个容积均为1 L的恒容密闭容器中仅发生反应:2NO2(g)![]() 2NO(g)+O2(g),容器I中5min达到平衡。相关数据如表所示:
2NO(g)+O2(g),容器I中5min达到平衡。相关数据如表所示:
容器编号 | 物质的起始浓度(mol/L) | 物质的平衡浓度(mol/L) | ||
c(NO2) | c(NO) | c(O2) | c(O2) | |
I | 0.6 | 0 | 0 | 0.2 |
Ⅱ | 0.3 | 0.5 | 0.2 | |
①容器Ⅱ在反应的起始阶段向_____(“正反应”、“逆反应”、“达平衡”)方向进行。
②达到平衡时,容器I与容器Ⅱ中的总压强之比为___________
a. >1 b. =1 c. <1

(3)NO2存在如下平衡:2NO2(g)![]() N2O4(g) △H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:υ(NO2)=k1·p2(NO2),υ(N2O4)=k2·P(N2O4),相应的速率与其分压关系如图所示。一定温度下,k1、k2与平衡常数kp(压力平衡常数,用平衡分压代替平衡浓度计算)间关系是k1=______;在上图标出点中,指出能表示反应达到平衡状态的点是_____,理由是______________。
N2O4(g) △H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:υ(NO2)=k1·p2(NO2),υ(N2O4)=k2·P(N2O4),相应的速率与其分压关系如图所示。一定温度下,k1、k2与平衡常数kp(压力平衡常数,用平衡分压代替平衡浓度计算)间关系是k1=______;在上图标出点中,指出能表示反应达到平衡状态的点是_____,理由是______________。
(4)可用NH3去除 NO,其反应原理4NH3+6NO=5N2+6H2O。不同温度条件下,n(NH3):n(NO)的物质的量之比分别为 4:1、3:1、1:3时,得到NO脱除率曲线如图所示:
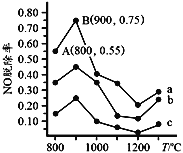
①曲线a中,NO的起始浓度为6×10-4 mg·m-3,从A点到B点经过0.8 s,该时间段内NO的脱除速率为_______mg/(m3·s)。
②曲线b对应NH3与NO的物质的量之比是_____。
(5)还可用间接电解法除NO。其原理如图所示:

①从A口中出来的物质的是__________________。
②写出电解池阴极的电极反应式_______________。
③用离子方程式表示吸收池中除去NO的原理__________________。