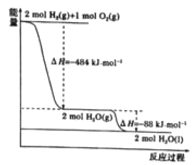
题目内容
【题目】【化学一选修5:有机化学基础】
有机物B能与碳酸氢钠溶液反应产生二氧化碳,且其苯环上―氯代物只有2种,G为C和F在一定条件下按照1:1反应生成的高分子化合物。请根据下列转化关系回答:
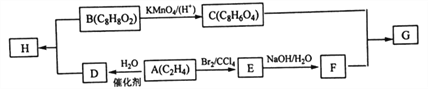
己知:![]()
(1) D中所含官能团的名称为______,E的名称为_______。
(2) G的结构简式为 ______;E→F的反应类型为______。
(3)下列有关说法正确的是_____(填序号)。
A.D可以发生银镜反应
B.1molC最多可与2molNaHCO3反应
C.C和F在一定的条件下可以反应生成环状化合物
D.H中所有的碳原子不可能在同一个平面上
(4)B和D反应生成H的化学方程式为_______________。
(5)同时符合下列条件B的同分异构体共有____种(不考虑立体异构);
①能发生银镜反应②含有苯环结构③能在碱性条件下水解
其中核磁共振氢谱中出现4组峰,且峰面积之比为3 : 2 : 2 : 1_______(写出结构简式)。
【答案】 羟基 1,2-二溴乙烷 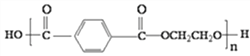 取代反应 BC
取代反应 BC ![]() 4
4 
【解析】A为乙烯,与水发生加成反应生成D为CH3CH2OH,乙烯与溴发生加成反应生成E为BrCH2CH2Br,E在氢氧化钠水溶液、加热条件下发生水解反应生成F为HOCH2CH2OH,B的分子式为C8H8O2,B能与碳酸氢钠溶液反应产生二氧化碳,含有-COOH,其苯环上一氯代物只有2种,则B为![]() ,B发生氧化反应生成C为
,B发生氧化反应生成C为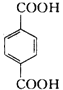 ,故H为
,故H为 ,G为C和F一定条件下1:1反应生成的高分子化合物,故G为
,G为C和F一定条件下1:1反应生成的高分子化合物,故G为![]() ;
;
(1)CH3CH2OH中所含官能团的名称为羟基,BrCH2CH2Br的名称为1,2-二溴乙烷;
(2) G的结构简式为![]() ;E在氢氧化钠水溶液、加热条件下发生水解反应生成HOCH2CH2OH,反应类型为取代反应;
;E在氢氧化钠水溶液、加热条件下发生水解反应生成HOCH2CH2OH,反应类型为取代反应;
(3)A.CH3CH2OH分子结构中无醛基,不可以发生银镜反应,故A错误;B.1mol 最多可与2molNaHCO3反应生成CO2,故B正确;C.
最多可与2molNaHCO3反应生成CO2,故B正确;C. 和HOCH2CH2OH在一定的条件下可以环酯化,反应生成环状酯,故C正确;D.
和HOCH2CH2OH在一定的条件下可以环酯化,反应生成环状酯,故C正确;D. 中苯环和羰基是平面结构,分子内所有的碳原子可能在同一个平面上,故D错误,答案为BC;
中苯环和羰基是平面结构,分子内所有的碳原子可能在同一个平面上,故D错误,答案为BC;
(4)![]() 和CH3CH2OH发生酯化反应反应生成H的化学方程式为
和CH3CH2OH发生酯化反应反应生成H的化学方程式为![]() ;
;
(5)B为![]() ,其同分异构体符合下列条件:①能发生银镜反应,含有-CHO;②含有苯环结构;③能在碱性条件下水解,含有酯基,故应为甲酸形成的酯,只有1个侧链,为-CH2OOCH,有1种,若有2个侧链,为-CH3、-OOCH,有邻、间、对3种位置关系,故符合条件的同分异构体共有4种;其中核磁共振氢谱中出现4组峰,且峰面积之比为3:2:2:1,应含有一个甲基,符合条件的同分异构体为:
,其同分异构体符合下列条件:①能发生银镜反应,含有-CHO;②含有苯环结构;③能在碱性条件下水解,含有酯基,故应为甲酸形成的酯,只有1个侧链,为-CH2OOCH,有1种,若有2个侧链,为-CH3、-OOCH,有邻、间、对3种位置关系,故符合条件的同分异构体共有4种;其中核磁共振氢谱中出现4组峰,且峰面积之比为3:2:2:1,应含有一个甲基,符合条件的同分异构体为:![]() 。
。

【题目】(l)将Cl2通入水中,Cl2部分与水反应:Cl2+H2O=H++Cl-+HClO。若要减少Cl2的溶解,可在氯水中加入少量________。
a.AgNO3晶体 b. CaCO3粉末 c. NaCl晶体 d.蒸馏水 e.浓盐酸
(2)在一定条件下,同时加入CO、H2O(g)、CO2、H2于一密闭容器中发生如下反应:CO +H2O(g)![]() CO2+H2,反应开始时向右进行。下列说法中不正确的是__________。
CO2+H2,反应开始时向右进行。下列说法中不正确的是__________。
a.反应开始时,正反应速率大于逆反应速率
b.反应开始时,正反应速率最大,逆反应速率为零
c.随着反应的进行,正反应速率逐渐减小,最后为零
d.随着反应的进行,逆反应速率增大,正反应速率减小,最后相等。
(3)一定条件下(温度值定), SO2与O2反应的浓度随时间的变化如下表
时间(min) | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
c(SO2)mol/L | 1.0 | |||||||
c(O2)mol/L | 0.5 | 0.35 | 0.25 | 0.18 | 0.1 | 0.05 | 0.05 | 0.05 |
C(SO3)mol/L | 0 | 0.3 | 0.5 | 0.65 | 0.8 | 0.9 | 0.9 | 0.9 |
由上表数据计算:
a.30min-40min 时间段,以SO2表示的反应速率为__________;
b.该温度下,正反应的平衡常数的值为__________________;
c.平衡时,SO2的转化率为_______;
(4)电解尿素[CO(NH3)2]的碱性溶液制氢气的装置示意图见下图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。电解时,阳极的电极反应式为____________。

(5)3.04g铜镁合金完全溶解于100mL密度为1.40g/mL、质量分数为63%的硝酸中,得到NO2气体2688mL(标准状况),向反应后的溶液中加入1.0mol/L NaOH溶液,当金属离子全部沉淀时,得到5.08g沉淀。则加入NaOH溶液的体积是_________mL。
【题目】【化学一选修3:物质结构与性质】
卤族元素单质与许多物质反应形成多种化合物。请利用所学物质结构与性质的相关知识回答:
(1)写出基态碘原子的价电子排布式___________;
(2)卤族元素的含氧酸中酸性最强的是____(写化学式),该酸根离子的立体构型为_________。
(3)比较下列锗的卤化物的熔点和沸点,分析其变化规律及原因_________。
GeCl4 | GeBr4 | GeI4 | |
熔点/℃ | -49.5 | 26 | 146 |
沸点/℃ | 83.1 | 186 | 约400 |
(4)己知高碘酸有两种形式,化学式分别为H5IO6(![]() )和HIO4,前者为五元酸,后者为一元酸,二者酸性强弱顺序为H5IO6_____ HIO4(填“>”、“<”或“=”)。H5IO6中σ键与π键的个数比为________。
)和HIO4,前者为五元酸,后者为一元酸,二者酸性强弱顺序为H5IO6_____ HIO4(填“>”、“<”或“=”)。H5IO6中σ键与π键的个数比为________。
(5)己知氯元素与第四周期最外层只有1个电子、次外层的所有原子轨道均充满电子的元素M形成的一种化合物的立方晶胞如图所示。
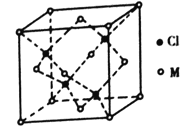
①该化合物的化学式为_______,己知晶胞参数a=0.542 nm,此晶体的密度为_____g/cm3。(写出计算式,不要求计算结果,阿伏加德罗常数为NA)