题目内容
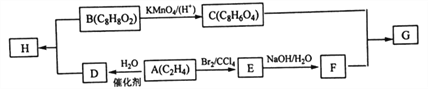
【题目】根据下图能量变化曲线判断,下列说法正确的是
A. H2(g)+1/2O2(g)=H2O(l) △H=-242kJ·mol-1
B. 若H—H、O==O的键能分别是436 kJ·mol-1和496 kJ·mol-1,则H—O的键能是463 kJ·mol-1
C. 据图可知,氢气的燃烧热为242 kJ·mol-1
D. 10克氢气在氧气中完全燃烧,放出热量为1210kJ
【答案】B
【解析】A.由图可知H2(g)+1/2O2(g)=H2O(g) △H=-242kJ·mol-1,故A错误;B.反应热△H=反应物的键能和-生成物的键能和,若H—H、O=O的键能分别是436 kJ·mol-1和496 kJ·mol-1,则 △H=(4×436 kJ·mol-1+496 kJ·mol-1)-(2×H—O的键能)=-242kJ·mol-1,得H—O的键能是463 kJ·mol-1,故B正确;C.氢气的燃烧热为1mol氢气完全燃烧生成液态水放出的热量,故C错误;D.10克氢气的物质的量为5mol,在氧气中完全燃烧生成气态水,放出热量为1210kJ,故D错误;答案为B。

练习册系列答案
相关题目