题目内容
8.已知A2-、B-、C+、D2+、E3+五种简单离子的核外电子数相等,则它们对应的核电荷数由大到小的顺序是( )| A. | A>B>C>D>E | B. | B>A>C>D>E | C. | C>D>E>A>B | D. | E>D>C>B>A |
分析 A2-、B-、C+、D2+、E3+五种简单离子的核外电子数相等,阳离子的电子数=原子序数-电荷数,阴离子的电子数=原子序数-电荷数.
解答 解:A2-、B-、C+、D2+、E3+五种简单离子的核外电子数相等,阳离子的电子数=原子序数-电荷数,阴离子的电子数=原子序数-电荷数,
则A+2=B+1=C-1=D-2=E-3,
所以原子序数关系为:E>D>C>B>A,故D正确,
故选D.
点评 本题考查原子结构与元素周期律的关系,题目难度不大,侧重于考查学生的分析能力,注意把握电子排布与原子序数的关系.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
13.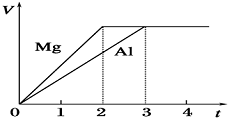 镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)的关系如图所示.反应中镁和铝的( )
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)的关系如图所示.反应中镁和铝的( )
 镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)的关系如图所示.反应中镁和铝的( )
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)的关系如图所示.反应中镁和铝的( )| A. | 摩尔质量之比为2:3 | B. | 失去的电子数之比为8:9 | ||
| C. | 反应速率之比为2:3 | D. | 质量之比为4:3 |
19.有四种氯化物,它们的通式为XCl2,其中最可能是第 IIA族元素的氯化物是( )
| A. | 白色固体,完全溶于水,得到一种无色中性溶液,此溶液导电性差 | |
| B. | 白色固体,易溶于水,得无色中性溶液,此溶液具有良好的导电性 | |
| C. | 白色固体,极易升华,如与水接触,可慢慢分解 | |
| D. | 绿色固体,易被氧化,得到一种蓝绿色溶液,此溶液具有良好的导电性 |
16.下列化学用语表达正确的是( )
| A. | HCl的电子式为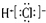 | |
| B. | S2-的结构示意图为 | |
| C. | O-16原子的符号为${\;}_{6}^{16}O$ | |
| D. | ${\;}_{12}^{6}C$、${\;}_{6}^{13}C$、${\;}_{6}^{14}C$含有相同的中子数 |
3.下列物质敞口露置于空气中,质量基本不变的是( )
| A. | 氢氧化钠 | B. | 氯化钠 | C. | 浓盐酸 | D. | 浓硫酸 |
20.下列说法正确的是( )
| A. | 标准状况下22.4L/mol 就是气体摩尔体积 | |
| B. | 非标准状况下,1mol 任何气体的体积不可能为22.4L | |
| C. | 标准状况下22.4L 任何气体都含有约6.02×1023个分子 | |
| D. | 1mol H2 和O2 的混合气体在标准状况下的体积约为44.8L |