题目内容
13.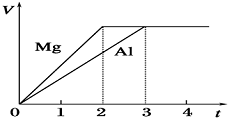 镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)的关系如图所示.反应中镁和铝的( )
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)的关系如图所示.反应中镁和铝的( )| A. | 摩尔质量之比为2:3 | B. | 失去的电子数之比为8:9 | ||
| C. | 反应速率之比为2:3 | D. | 质量之比为4:3 |
分析 等浓度、等体积的过量稀硫酸反应,则Mg、Al完全反应,由图可知,生成氢气相同,则Mg、Al失去电子相同,即2n(Mg)=3n(Al),以此来解答.
解答 解:A.摩尔质量之比为24g/mol:27g/mol=8:9,故A错误;
B.由图可知,生成氢气相同,则Mg、Al失去电子相同,故B错误;
C.Mg反应快,速率与时间成反比,则反应速率之比为3:2,故C错误;
D.生成氢气相同,则Mg、Al失去电子相同,即2n(Mg)=3n(Al),则质量比为$\frac{24×3}{27×2}$=4:3,故D正确;
故选D.
点评 本题考查化学反应方程式的计算,为高频考点,把握图象中气体相同、反应中酸过量为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
3.实验中下列操作不正确的是( )
| A. | 蒸馏实验时,将温度计的水银球插入液体中 | |
| B. | 蒸馏实验时,冷凝水应下进上出 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 蒸发操作时,应使混合物中剩有少量水份时即停止加热 |
4.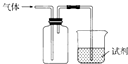 图装置可用于收集气体并验证其化学性质,下列对应关系完全正确的是( )
图装置可用于收集气体并验证其化学性质,下列对应关系完全正确的是( )
 图装置可用于收集气体并验证其化学性质,下列对应关系完全正确的是( )
图装置可用于收集气体并验证其化学性质,下列对应关系完全正确的是( )| 选项 | 气体 | 试剂 | 现象 | 结论 |
| A | CO2 | 酚酞试液 | 溶液变红 | CO2与水反应生成酸 |
| B | C2H4 | 溴水 | 溶液褪色 | 乙烯能与溴发生加成反应 |
| C | SO2 | 酸性KMnO4溶液 | 溶液褪色 | SO2有还原性 |
| D | NH3 | MgCl2溶液 | 产生白色沉淀 | NH3有碱性 |
| A. | A | B. | B | C. | C | D. | D |
1.下列有关物质性质比较的叙述中不正确的是( )
| A. | 稳定性:溶液>胶体>浊液 | B. | 溶解性:NaHCO3>Na2CO3 | ||
| C. | 酸性:HCl>H2CO3>HClO | D. | 氧化性:浓HNO3>稀HNO3>稀HCl |
8.某同学设计如图所示装置分别进行探究实验(夹持装置已略去)
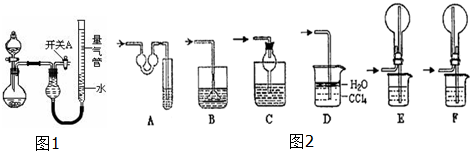
请回答下列问题:
(1)简述如何检查该装置的气密性:量气管中加水后关闭开关A和分液漏斗活塞,微热烧瓶,量气管右端液面升高且保持不变,说明气密性好.
(2)该同学认为实验①可通过收集测量NO气体的体积,来探究Cu样品的纯度.你认为是否可行?请简述原因.不可行,因为NO会与装置中空气反应后溶于水,使测得的NO气体体积不准.
(3)实验②中剩余的NH3需吸收处理.以下各种尾气吸收装置中,适合于吸收NH3,而且能防止倒吸的有ACDF
(4)实验③中,量气管中的液体最好是D.
A.H2O B.CCl4 C.饱和Na2CO3溶液 D.饱和NaHCO3溶液
(5)本实验应对量气管多次读数,读数时应注意:
①恢复至室温,②使量气管两端液面相平,③视线与凹液面最低处相平.
(6)实验④获得以下数据(所有气体体积均已换算成标准状况)
根据上述合理数据计算镁铝合金中铝的质量分数27.0%.

| 实验 | 药品 | 制取气体 | 量气管中的液体 |
| ① | Cu、稀HNO3 | H2O | |
| ② | NaOH固体、浓氨水 | NH3 | |
| ③ | Na2CO3固体、稀H2SO4 | CO2 | |
| ④ | 镁铝合金、NaOH溶液(足量) | H2 | H2O |
(1)简述如何检查该装置的气密性:量气管中加水后关闭开关A和分液漏斗活塞,微热烧瓶,量气管右端液面升高且保持不变,说明气密性好.
(2)该同学认为实验①可通过收集测量NO气体的体积,来探究Cu样品的纯度.你认为是否可行?请简述原因.不可行,因为NO会与装置中空气反应后溶于水,使测得的NO气体体积不准.
(3)实验②中剩余的NH3需吸收处理.以下各种尾气吸收装置中,适合于吸收NH3,而且能防止倒吸的有ACDF
(4)实验③中,量气管中的液体最好是D.
A.H2O B.CCl4 C.饱和Na2CO3溶液 D.饱和NaHCO3溶液
(5)本实验应对量气管多次读数,读数时应注意:
①恢复至室温,②使量气管两端液面相平,③视线与凹液面最低处相平.
(6)实验④获得以下数据(所有气体体积均已换算成标准状况)
| 编号 | 镁铝合金质量 | 量气管第一次读数 | 量气管第二次读数 |
| ① | 1.0g | 10.0mL | 346.3mL |
| ② | 1.0g | 10.0mL | 335.0mL |
| ③ | 1.0g | 10.0mL | 345.7mL |
18.聚丙烯酸酯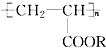 类涂料是目前市场上流行的墙面涂料之一,同时它也能“使沙漠变绿洲”.这是因为聚丙烯酸酯能与沙土粒子结合,在地表下30~50cm处形成一个厚0.5cm的隔水层,从而既阻止了地下的盐分上升,又有拦截、蓄积雨水的作用.下列关于聚丙烯酸酯的说法,正确的是( )
类涂料是目前市场上流行的墙面涂料之一,同时它也能“使沙漠变绿洲”.这是因为聚丙烯酸酯能与沙土粒子结合,在地表下30~50cm处形成一个厚0.5cm的隔水层,从而既阻止了地下的盐分上升,又有拦截、蓄积雨水的作用.下列关于聚丙烯酸酯的说法,正确的是( )
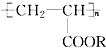 类涂料是目前市场上流行的墙面涂料之一,同时它也能“使沙漠变绿洲”.这是因为聚丙烯酸酯能与沙土粒子结合,在地表下30~50cm处形成一个厚0.5cm的隔水层,从而既阻止了地下的盐分上升,又有拦截、蓄积雨水的作用.下列关于聚丙烯酸酯的说法,正确的是( )
类涂料是目前市场上流行的墙面涂料之一,同时它也能“使沙漠变绿洲”.这是因为聚丙烯酸酯能与沙土粒子结合,在地表下30~50cm处形成一个厚0.5cm的隔水层,从而既阻止了地下的盐分上升,又有拦截、蓄积雨水的作用.下列关于聚丙烯酸酯的说法,正确的是( )| A. | 从物质分类的角度看,聚丙烯酸酯属于离子化合物 | |
| B. | 它是由CH2═CH-COOR经过加聚反应而得到的高分子化合物 | |
| C. | 在一定条件下,它可以发生加成反应 | |
| D. | 在一定条件下,它可以发生酯化反应 |
5.0.2mol有机物和0.4molO2在密闭容器中燃烧后的产物为CO2、CO和H2O(g).产物经过浓硫酸后,浓硫酸的质量增加10.8g;再通过灼热CuO充分反应后,固体质量减轻3.2g;最后气体再通过碱石灰被完全吸收,碱石灰质量增加17.6g.0.1mol该有机物恰好与4.6g金属钠完全反应.下列关于该有机物的说法不正确的是( )
| A. | 该化合物的相对分子质量是62 | |
| B. | 该化合物的化学式为C2H6O2 | |
| C. | 1mol该化合物能与2molO2发生催化氧化反应 | |
| D. | 1mol该有机物最多能与2molNa反应 |
8.已知A2-、B-、C+、D2+、E3+五种简单离子的核外电子数相等,则它们对应的核电荷数由大到小的顺序是( )
| A. | A>B>C>D>E | B. | B>A>C>D>E | C. | C>D>E>A>B | D. | E>D>C>B>A |
