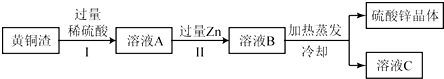
题目内容
13.某一反应体系中存在下列6中微粒:ClO-、CN-、HCO3-、N2、Cl-和H2O,已知反应中氧化剂与还原剂的物质的量之比为5:2,请完成下列各题:(1)CN-中碳元素的化合价为+2,该反应的氧化产物是HCO3-和N2.
(2)反应中1mol还原剂失去(填“得到”或“失去”)5mol电子.
(3)该反应的离子方程式为5ClO-+2CN-+H2O=N2↑+5Cl-+2HCO3-.
(4)ClO-和Cl-在强酸性条件下不能大量共存,其原因是ClO-+Cl-+2H+=Cl2↑+H2O(用离子方程式表示).
分析 由具有氧化性的ClO-为反应物降低到Cl-,由CN-化合价升高为HCO3-、N2可知CN-是还原剂,又氧化剂与还原剂的物质的量之比为5:2可知,则再结合原子守恒反应的方程式应为5ClO-+2CN-+H2O=N2↑+5Cl-+2HCO3-,以此解答该题.
解答 解:由具有氧化性的ClO-为反应物降低到Cl-,由CN-化合价升高为HCO3-、N2可知CN-是还原剂,又氧化剂与还原剂的物质的量之比为5:2可知,则再结合原子守恒反应的方程式应为5ClO-+2CN-+H2O=N2↑+5Cl-+2HCO3-,
(1)CN-中氮为-3价,所以碳元素的化合价为+2价,该反应的氧化产物是HCO3-和N2.故答案为:+2;HCO3-和N2;
(2)根据以上分析,CN-化合价升高为HCO3-、N2可知CN-是还原剂,则反应中1mol还原剂失去2+3=5mol电子,故答案为:5;
(3)根据以上分析,该反应的离子方程式为5ClO-+2CN-+H2O=N2↑+5Cl-+2HCO3-,故答案为:5ClO-+2CN-+H2O=N2↑+5Cl-+2HCO3-;
(4)ClO-和Cl-在强酸性条件下发生归中反应生成氯气和水,离子方程式为:ClO-+Cl-+2H+=Cl2↑+H2O,故答案为:ClO-+Cl-+2H+=Cl2↑+H2O;
点评 本题考查氧化还原反应的分析和计算,为高考常见题型和高频考点,侧重于学生的分析能力和计算能力的考查,注意从元素化合价的角度认识氧化还原反应的相关概念和物质的性质,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.聚丙烯酸酯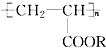 类涂料是目前市场上流行的墙面涂料之一,同时它也能“使沙漠变绿洲”.这是因为聚丙烯酸酯能与沙土粒子结合,在地表下30~50cm处形成一个厚0.5cm的隔水层,从而既阻止了地下的盐分上升,又有拦截、蓄积雨水的作用.下列关于聚丙烯酸酯的说法,正确的是( )
类涂料是目前市场上流行的墙面涂料之一,同时它也能“使沙漠变绿洲”.这是因为聚丙烯酸酯能与沙土粒子结合,在地表下30~50cm处形成一个厚0.5cm的隔水层,从而既阻止了地下的盐分上升,又有拦截、蓄积雨水的作用.下列关于聚丙烯酸酯的说法,正确的是( )
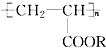 类涂料是目前市场上流行的墙面涂料之一,同时它也能“使沙漠变绿洲”.这是因为聚丙烯酸酯能与沙土粒子结合,在地表下30~50cm处形成一个厚0.5cm的隔水层,从而既阻止了地下的盐分上升,又有拦截、蓄积雨水的作用.下列关于聚丙烯酸酯的说法,正确的是( )
类涂料是目前市场上流行的墙面涂料之一,同时它也能“使沙漠变绿洲”.这是因为聚丙烯酸酯能与沙土粒子结合,在地表下30~50cm处形成一个厚0.5cm的隔水层,从而既阻止了地下的盐分上升,又有拦截、蓄积雨水的作用.下列关于聚丙烯酸酯的说法,正确的是( )| A. | 从物质分类的角度看,聚丙烯酸酯属于离子化合物 | |
| B. | 它是由CH2═CH-COOR经过加聚反应而得到的高分子化合物 | |
| C. | 在一定条件下,它可以发生加成反应 | |
| D. | 在一定条件下,它可以发生酯化反应 |
8.已知A2-、B-、C+、D2+、E3+五种简单离子的核外电子数相等,则它们对应的核电荷数由大到小的顺序是( )
| A. | A>B>C>D>E | B. | B>A>C>D>E | C. | C>D>E>A>B | D. | E>D>C>B>A |
2.关于Na2CO3和NaHCO3,下列说法中正确的是( )
| A. | Na2CO3比NaHCO3易溶于水 | |
| B. | NaHCO3比Na2CO3稳定 | |
| C. | 石灰水能与NaHCO3反应,但不与Na2CO3反应 | |
| D. | 等质量的Na2CO3和NaHCO3与盐酸反应,消耗HCl的质量比为42:53 |
3.ClO2是一种消毒杀菌效率高、二次污染小的水处理剂.实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4$\frac{\underline{\;△\;}}{\;}$2ClO2↑+K2SO4+2CO2↑+2H2O下列说法不正确的是( )
| A. | KClO3在反应中得到电子 | |
| B. | ClO2是氧化产物 | |
| C. | H2C2O4在反应中被氧化 | |
| D. | 1 molKClO3参加反应有1mol电子转移 |
 Al(OH)3+OH-.
Al(OH)3+OH-.
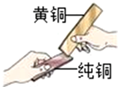 合金是重要的金属材料.
合金是重要的金属材料.