题目内容
19.有四种氯化物,它们的通式为XCl2,其中最可能是第 IIA族元素的氯化物是( )| A. | 白色固体,完全溶于水,得到一种无色中性溶液,此溶液导电性差 | |
| B. | 白色固体,易溶于水,得无色中性溶液,此溶液具有良好的导电性 | |
| C. | 白色固体,极易升华,如与水接触,可慢慢分解 | |
| D. | 绿色固体,易被氧化,得到一种蓝绿色溶液,此溶液具有良好的导电性 |
分析 第IIA族元素的氯化物中只存在离子键,属于离子化合物,且属于强酸强碱盐,且都易溶液水,其水溶液呈中性.
解答 解:第IIA族元素的氯化物属于强酸强碱盐,为离子化合物,其熔点较高,且易溶于水,阴阳离子不水解,所以溶于水后得到无色中性溶液,该氯化物在水溶液里电离出自由移动的阴阳离子而使其溶液导电,故选B.
点评 本题考查物质的结构、性质,从物质的颜色、熔点、溶解性、溶液酸碱性、溶液导电性方面考查,明确第IIA族氯化物的结构、性质即可解答,注意基础知识的灵活运用.

练习册系列答案
 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
4.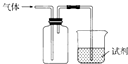 图装置可用于收集气体并验证其化学性质,下列对应关系完全正确的是( )
图装置可用于收集气体并验证其化学性质,下列对应关系完全正确的是( )
 图装置可用于收集气体并验证其化学性质,下列对应关系完全正确的是( )
图装置可用于收集气体并验证其化学性质,下列对应关系完全正确的是( )| 选项 | 气体 | 试剂 | 现象 | 结论 |
| A | CO2 | 酚酞试液 | 溶液变红 | CO2与水反应生成酸 |
| B | C2H4 | 溴水 | 溶液褪色 | 乙烯能与溴发生加成反应 |
| C | SO2 | 酸性KMnO4溶液 | 溶液褪色 | SO2有还原性 |
| D | NH3 | MgCl2溶液 | 产生白色沉淀 | NH3有碱性 |
| A. | A | B. | B | C. | C | D. | D |
5.0.2mol有机物和0.4molO2在密闭容器中燃烧后的产物为CO2、CO和H2O(g).产物经过浓硫酸后,浓硫酸的质量增加10.8g;再通过灼热CuO充分反应后,固体质量减轻3.2g;最后气体再通过碱石灰被完全吸收,碱石灰质量增加17.6g.0.1mol该有机物恰好与4.6g金属钠完全反应.下列关于该有机物的说法不正确的是( )
| A. | 该化合物的相对分子质量是62 | |
| B. | 该化合物的化学式为C2H6O2 | |
| C. | 1mol该化合物能与2molO2发生催化氧化反应 | |
| D. | 1mol该有机物最多能与2molNa反应 |
14.下列关于“焰色反应”的理解正确的是( )
| A. | 只有金属单质才有焰色反应 | B. | 只有金属化合物才有焰色反应 | ||
| C. | 某些金属或其化合物都有焰色反应 | D. | 只有金属离子才有焰色反应 |
11.运用元素周期律分析下面的推断,其中不正确的是( )
| A. | 锂(Li)与水反应比钠与水反应剧烈 | |
| B. | 砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸 | |
| C. | 在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂 | |
| D. | HBrO4的酸性比HClO4弱 |
8.已知A2-、B-、C+、D2+、E3+五种简单离子的核外电子数相等,则它们对应的核电荷数由大到小的顺序是( )
| A. | A>B>C>D>E | B. | B>A>C>D>E | C. | C>D>E>A>B | D. | E>D>C>B>A |
