题目内容
17.(1)用单线桥标出电子转移的方向和数目:Cu+4HNO3═Cu(NO3)2+2NO2↑+2H2O(2)在反应Cl2+2KOH═KCl+KClO+H2O中Cl2是氧化剂,KClO是氧化产物,当有149gKCl产生时,被氧化的氯气是1mol.该反应的离子方程式是Cl2+2OH-=Cl-+ClO-+H2O.
分析 (1)氧化还原反应中,得电子化合价降低的反应物是氧化剂,失电子化合价升高的反应物是还原剂,根据元素化合价变化计算转移电子数;
(2)有元素化合价降低的物质为氧化剂,还原剂被氧化得到氧化产物,根据方程式计算.
解答 解:(1)该反应中铜元素的化合价变化为0价→+2价,氮元素的化合价变化为+5价→+4价,所以得失电子的最小公倍数是2,所以其电子转移的方向和数目为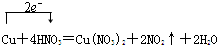 ,
,
故答案为: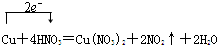 ;
;
(2)在反应Cl2+2KOH═KCl+KClO+H2O中氯气中Cl元素化合价降低,Cl2为氧化剂,化合价升高被氧化得到氧化产物KClO,当有149g即2molKCl产生时,消耗2molCl2,其中被氧化的Cl2为1mol,该反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O;
故答案为:Cl2;KClO;1;Cl2+2OH-=Cl-+ClO-+H2O.
点评 本题考查了氧化还原反应,明确元素化合价变化是解本题关键,难点是电子转移的方向和数目的分析,题目难度不大.

练习册系列答案
 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案
相关题目
8.已知A2-、B-、C+、D2+、E3+五种简单离子的核外电子数相等,则它们对应的核电荷数由大到小的顺序是( )
| A. | A>B>C>D>E | B. | B>A>C>D>E | C. | C>D>E>A>B | D. | E>D>C>B>A |
12.能用H++OH-=H2O表示的是( )
| A. | NaOH溶液和CO2的反应 | B. | NaOH溶液和醋酸的反应 | ||
| C. | NaOH溶液和盐酸反应 | D. | 氨水和稀H2SO4的反应 |
2.关于Na2CO3和NaHCO3,下列说法中正确的是( )
| A. | Na2CO3比NaHCO3易溶于水 | |
| B. | NaHCO3比Na2CO3稳定 | |
| C. | 石灰水能与NaHCO3反应,但不与Na2CO3反应 | |
| D. | 等质量的Na2CO3和NaHCO3与盐酸反应,消耗HCl的质量比为42:53 |
6.下列各组物质的稀溶液相互反应,把前者逐滴滴入后者与把后者逐滴滴入前者,所产生的现象相同的是( )
| A. | AlCl3 和NaOH | B. | Na2CO3和HCl | C. | Na2CO3和H2SO4 | D. | NaCl和AgNO3 |
7.下列说法中不正确的是( )
| A. | 电负性的大小顺序为Cl>S>P | |
| B. | 由于NO3-和SO3互为等电子体,所以可以推断NO3-的空间构型为平面三角形 | |
| C. | 根据晶格能的大小可以判断MgCl2的熔点比CaCl2高 | |
| D. | 液态HF的沸点比液态HCl的沸点高是因为氢氟键的键能比氢氯键的键能大 |

