题目内容
11.下列对原子核外电子的描述不正确的是( )| A. | 核外电子是分层排布的 | |
| B. | 在化学变化中,活泼金属元素容易失去电子形成阳离子,活泼非金属元素溶液得到电子形成阴离子 | |
| C. | 活泼金属或非金属元素通过电子得失形成离子时,最外层电子趋向于形成类似稀有气体原子的稳定结构 | |
| D. | 原子核外电子绕核做圆周运动 |
分析 A.核外电子从近到远是分层排布的;
B.活泼金属元素容易失去电子,活泼非金属元素溶液得到电子;
C.活泼金属容易失去电子形成类似稀有气体原子的稳定结构,非金属元素易得到电子形成类似稀有气体原子的稳定结构;
D.电子的质量很小,在原子核外作高速运动.
解答 解:A.核外电子从近到远是分层排布的,故A正确;
B.活泼金属元素容易失去电子形成阳离子,活泼非金属元素溶液得到电子形成阴离子,故B正确;
C.活泼金属容易失去电子形成类似稀有气体原子的稳定结构,非金属元素易得到电子形成类似稀有气体原子的稳定结构,故C正确;
D.电子的质量很小,在原子核外作高速运动,且运动不规则,故D错误;
故选D.
点评 本题考查了原子核外电子的运动状态及金属和非金属的性质,难度不大,注意基础知识的积累.

练习册系列答案
相关题目
4. 如图所示,将氯气通入装置.若打开活塞b,则小试管里的干燥品红试纸c不褪色;若关闭活塞b,则c不久褪色.则a溶液是( )
如图所示,将氯气通入装置.若打开活塞b,则小试管里的干燥品红试纸c不褪色;若关闭活塞b,则c不久褪色.则a溶液是( )
 如图所示,将氯气通入装置.若打开活塞b,则小试管里的干燥品红试纸c不褪色;若关闭活塞b,则c不久褪色.则a溶液是( )
如图所示,将氯气通入装置.若打开活塞b,则小试管里的干燥品红试纸c不褪色;若关闭活塞b,则c不久褪色.则a溶液是( )| A. | 浓盐酸 | B. | 浓硫酸 | C. | 饱和食盐水 | D. | NaOH溶液 |
2.下列有关项目的比较中,错误的是( )
| A. | 酸性:H2SO4>HClO4 | B. | 氧化性:Fe3+>Fe2+ | ||
| C. | 稳定性:HBr<HCl | D. | 原子半径 Na>Mg |
19.设NA代表阿伏伽德罗常数的数值,下列说法中正确的是( )
| A. | 1L 1mol•L-1 K2Cr2O2溶液中Cr2O72-的数目为NA | |
| B. | 1mol C60F60分子中碳原子之间共用电子对数目为90NA | |
| C. | 电解精炼铜时,若阴极得到电子数为2NA,则阳极质量减少64g | |
| D. | 标准状况下,2.24L Cl2完全溶于水,转移电子数为0.1NA |
6.下列离子方程式书写正确的是( )
| A. | 澄清石灰水中加入盐酸:Ca(OH)2+2H+═2H2O+Ca2+ | |
| B. | 硫酸与氢氧化钡溶液反应:Ba2++OH-+SO42-+H+═BaSO4↓+H2O | |
| C. | 碳酸氢钙和过量的氢氧化钠溶液反应:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| D. | 铁与氯化铁溶液反应:Fe+2Fe3+═3Fe2+ |
8.分类是化学学习和研究中常用的思维方法,下列关于化学物质和反应类型关系正确的是( )
| A. | 物质$\left\{\begin{array}{l}{混合物}\\{纯净物\left\{\begin{array}{l}{溶液}\\{化合物}\end{array}\right.}\end{array}\right.$ | B. |  | ||
| C. | 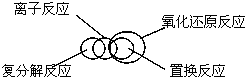 | D. | 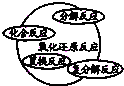 |
5.赤铜矿的成分是Cu2O,辉铜矿的成分是Cu2S,将赤铜矿与辉铜矿混合加热有以下反应:2Cu2O+Cu2S$\frac{\underline{\;\;△\;\;}}{\;}$6Cu+SO2↑,对于该反应,下列说法正确的是( )
| A. | 该反应的氧化剂只有Cu2O | |
| B. | Cu既是氧化产物,又是还原产物 | |
| C. | Cu2S在反应中既是氧化剂又是还原剂 | |
| D. | 还原产物与氧化产物的物质的量之比为1:6 |

 .
. 、
、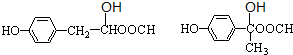 .
.