题目内容
盖斯定律认为:不管化学过程是一步完成或分为数步完成,这个过程的热效应是相同的。
已知:H2O(g)=H2O(l)ΔH1 =-Q1kJ/mol
C2H5OH(g)=C2H5OH(l) ΔH2 =-Q2kJ/mol
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH3 =-Q3kJ/mol
若使0.5mol乙醇液体完全燃烧,最后恢复到室温,则放出的热量为(kJ)
| A.Q1+Q2+Q3 |
| B.0.5(Q1+Q2+Q3) |
| C.0.5 Q2-1.5 Q1-0.5Q3 |
| D.1.5 Q1-0.5 Q2+0.5Q3 |
D
解析试题分析:①H2O(g)═H2O(l)△H1=-Q1kJ?mol-1,②C2H5OH(g)═C2H5OH(l)△H2=-Q2kJ?mol-1,③C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H3=-Q3kJ?mol-1,根据盖斯定律可知,
①×3-②+③得C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=(3Q1-Q2+Q3)kJ/mol,
即1mol液态酒精完全燃烧并恢复至室温,则放出的热量为(3Q1-Q2+Q3)kJ,则0.5mol液态酒精完
全燃烧并恢复至室温,则放出的热量为0.5×(3Q1-Q2+Q3)kJ=1.5Q1-0.5Q2+0.5Q3。
考点:用盖斯定律进行有关反应热的计算

下列说法正确的组合是( )
(1)放热反应不需要加热就能反应,吸热反应不加热就不能反应
(2)物质发生化学变化都伴有能量的变化
(3)伴有能量变化的物质变化都是化学变化
(4)吸热反应和放热反应都有可能自发进行
(5)Na转化为Na+时,吸收的能量就是该过程的反应热
(6)水蒸气变为液态水时放出的能量就是该变化的反应热
| A.(1)(2) | B.(3)(5) | C.(2)(6) | D.(2)(4) |
反应CO(g)+2H2(g)  CH3OH(g)过程中的能量变化情况如下图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是
CH3OH(g)过程中的能量变化情况如下图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是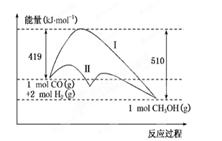
| A.该反应的ΔH=+91 kJ/mol |
| B.加入催化剂,正、逆反应的活化能数值均减小 |
| C.加入催化剂,该反应的ΔH变小 |
| D.如果该反应生成液态CH3OH,则ΔH变大 |
在下列各说法中,正确的是
| A.ΔH >0表示放热反应,ΔH <0表示吸热反应 |
| B.1mol H2SO4与1mol Ba(0H)2反应生成BaSO4沉淀时放出的热叫做中和热 |
| C.1mol H2与0.5mol O2反应放出的热就是H2的燃烧热 |
| D.热化学方程式中的化学计量数只表示物质的量,可以是分数 |
下列反应属于吸热反应的是
| A.碳与水蒸气制水煤气的反应 | B.生石灰和水的反应 |
| C.盐酸与氢氧化钠溶液的反应 | D.木炭在氧气中燃烧 |
已知反应:
①101 kPa时,2C(s)+O2(g) =2CO(g) ΔH=-221 kJ·mol-1
②稀溶液中,H+(aq)+OH-(aq) =H2O(l) ΔH=-57.3 kJ·mol-1
③在同温同压下,S(g)+O2(g)=SO2(g) ΔH1
下列结论正确的是( )
| A.H2SO4和Ba(OH)2反应的中和热ΔH=2×(-57.3)kJ/mol |
| B.C的标准燃烧热为-110.5 kJ·mol-1 |
| C.稀醋酸与稀NaOH溶液反应生成1 mol水放出的热量为57.3 kJ |
| D.由③知S(s)+O2(g)=SO2(g)ΔH2则ΔH2>ΔH1 |
下列关于热化学反应的描述中正确的是
| A.HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol |
| B.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
| C.需要加热才能发生的反应一定是吸热反应 |
| D.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g) =2CO(g)+O2(g)反应的△H=2×283.0kJ/mol |


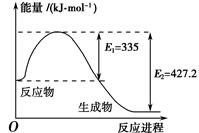
 2NH3(g) ΔH=a kJ·mol-1。
2NH3(g) ΔH=a kJ·mol-1。