题目内容
16. 金属镍及其化合物在合金材料以及催化剂等方面应用广泛.
金属镍及其化合物在合金材料以及催化剂等方面应用广泛.(1)基态镍原的外围电子排式为3d84s2.
(2)金属镍能与CO形成配合物Ni(CO)4,写出与CO互为等电子体的一种分子和一种离子的化学式N2、CN-.
(3)很多不饱和有机物在Ni催化下可与H2发生加成反应.如①CH2=CH2、②HC≡CH、③
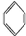 、④HCHO,其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形.
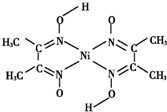
、④HCHO,其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形.(4)丁二酮肟常用于检验Ni2+.在稀氨水中,丁二酮肟与Ni2+反应生成鲜红色沉淀,其结构如图所示.该结构中,除共价键外还存在配位键,请在图中用箭头表示出配位键.
分析 (1)Ni是28号元素,根据能量最低原则、泡利不相容原理和洪特规则,写出其核外电子排布式为:1s22s22p43s23p43d84s2,据此判断其外围电子排布式;
(2)根据等电子体中原子数相同、价电子数相同分析;
(3)根据碳原子含有的σ键和孤电子对判断碳原子采取的杂化方式; 根据价层电子对互斥理论判断甲醛的空间构型;
(4)中心原子提供空轨道配体提供孤电子对形成配位键,Ni含有空轨道、N原子含有孤电子对.
解答 解:(1)Ni是28号元素,其核外电子排布式为:1s22s22p43s23p43d84s2,价电子数为10,价电子排布式为3d84s2,故答案为:3d84s2;
(2)CO含有2个原子14个电子,所以CO互为等电子体的一种分子和一种离子的化学式为:N2、CN-(或O22+、C22-、NO+),故答案为:N2;CN-;
(3)①CH2=CH2中每个碳原子含有3个σ键,不含孤电子对,所以采取sp2杂化,故正确;
②HC≡CH中每个碳原子含有2个σ键,不含孤电子对,所以采取sp杂化,故错误;
③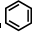 中每个碳原子含有3个σ键,不含孤电子对,所以采取sp2杂化,故正确;
中每个碳原子含有3个σ键,不含孤电子对,所以采取sp2杂化,故正确;
④HCHO中碳原子含有3个σ键,不含孤电子对,所以采取sp2杂化,故正确;
HCHO中碳原子含有3个σ键,不含孤电子对,所以其空间构型是平面三角形;
故答案为:①③④; 平面三角;
(4)配位键由含有孤电子对的原子指向含有空轨道的原子,Ni含有空轨道、N原子含有孤电子对,所以配位键由N原子指向Ni原子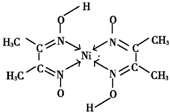 ,
,
故答案为: .
.
点评 本题考查了价电子的排布式、配位键、原子杂化方式判断等知识点,题目难度中等,难点是配位键表示方法,明确配位键是由提供孤电子对的原子指向提供空轨道的原子是解答关键.

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目
6.下列反应不属于消去反应的是( )
| A. | 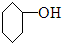 $\stackrel{浓H_{2}SO_{4}△}{→}$ $\stackrel{浓H_{2}SO_{4}△}{→}$ +H2O +H2O | |
| B. | CH3CHBrCH3+NaOH$→_{△}^{醇}$CH3CH=CH2↑+NaBr+H2O | |
| C. | 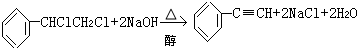 | |
| D. | 2CH3OH$→_{△}^{浓硫酸}$CH3-O-CH3+H2O |
7.下列关于化学反应与能量的说法正确的是( )
| A. | 放热反应在常温下一定很容易发生 | |
| B. | 化学反应一定既伴随着物质变化又伴随着能量变化 | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | 反应物所具有的总能量高于生成物所具有的总能量的反应为吸热反应 |
4.关于分子式为“C4H8”的物质叙述正确的是( )
| A. | 与乙烯互为同系物 | |
| B. | 其具有6种同分异构体 | |
| C. | 其一氯代物一共有12种 | |
| D. | 该物质的系统命名的名称为“1-丁烯” |
11.下列说法正确的是( )
| A. | 油脂是植物油和动物脂肪的统称,分子的不饱和程度越大,熔点越低 | |
| B. | 氨基酸、二肽、蛋白质均既能跟强酸反应又能跟强碱反应,是两性氧化物 | |
| C. | 石油经裂化得到的汽油可用来萃取溴水中的Br2 | |
| D. | 麻黄碱(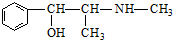 )的催化氧化产物能发生银镜反应 )的催化氧化产物能发生银镜反应 |
1.将SO2通人BaCl2溶液中至饱和未见有沉淀生成,继续通入另一气体,仍无沉淀生成,则该气体可能为( )
| A. | NO2 | B. | NH3 | C. | Cl2 | D. | HI |
8.短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13,X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者Y原子最外层电子数的3倍.下列说法正确的是( )
| A. | X的氢化物溶于水显酸性且稳定性弱于HF | |
| B. | Y的氧化物是离子化合物,Y的氢氧化物碱性比氢氧化钠弱 | |
| C. | Z的氢化物的水溶液在空气中存放不易变质 | |
| D. | X和Z的最高价氧化物对应的水化物都是弱酸 |
5.从苯酚的乙醇溶液中回收苯酚的实验中,操作步骤合理的是( )
①蒸馏 ②过滤 ③静置分液 ④加入足量钠 ⑤通入足量CO2⑥加入足量NaOH溶液 ⑦加入乙酸和浓硫酸的混合液加热.
①蒸馏 ②过滤 ③静置分液 ④加入足量钠 ⑤通入足量CO2⑥加入足量NaOH溶液 ⑦加入乙酸和浓硫酸的混合液加热.
| A. | ④⑤③ | B. | ⑥①⑤③ | C. | ③⑤①② | D. | ⑥① |
6.据报道,锌电池可能取代目前广泛使用的铅蓄电池,因为锌电池容量更大,而且没有铅污染.其电池反应为:2Zn+O2=2ZnO,原料为锌粒、电解液和空气,则下列叙述正确的是( )
| A. | 锌为正极,空气进入负极反应 | B. | 负极反应为:Zn-2e-=Zn2+ | ||
| C. | 正极发生氧化反应 | D. | 正极反应为:Zn-2e-=Zn2+ |