题目内容
6.据报道,锌电池可能取代目前广泛使用的铅蓄电池,因为锌电池容量更大,而且没有铅污染.其电池反应为:2Zn+O2=2ZnO,原料为锌粒、电解液和空气,则下列叙述正确的是( )| A. | 锌为正极,空气进入负极反应 | B. | 负极反应为:Zn-2e-=Zn2+ | ||
| C. | 正极发生氧化反应 | D. | 正极反应为:Zn-2e-=Zn2+ |
分析 A.负极发生氧化反应,正极发生还原反应;
B.锌作负极,负极上锌失电子得到Zn2+;
C.正极上得到电子,发生还原反应;
D.正极发生还原反应,氧气获得电子.
解答 解:A.锌的失去电子化合价升高,发生氧化反应做原电池的负极,氧气得到电子发生还原反应,所以空气进入正极进行反应,故A错误;
B.锌作负极,负极上锌失电子得到Zn2+,负极反应为:Zn-2e-=Zn2+,故B正确;
C.正极上得电子发生还原反应,故C错误;
D.正极发生还原反应,氧气获得电子,故D错误;
故选B.
点评 本题考查原电池原理,根据元素化合价变化来确定正负极及电极反应类型,难度不大.

练习册系列答案
相关题目
17.下列有关实验装置进行的相应实验,能达到实验目的是( )
| A. | 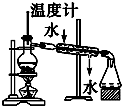 用图分离两种互溶但沸点相差较大的液体混合物 | |
| B. | 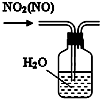 用图所示装置可除去NO2中的NO | |
| C. | 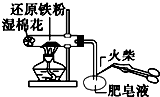 用图检验铁粉与水蒸气反应产生的氢气 | |
| D. | 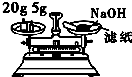 用图称量氢氧化钠固体 |
1.下列物质属于同分异构体的一组是( )
| A. | 淀粉和纤维素 | B. | C2H6与C3H8 | ||
| C. | O2与O3 | D. | CH3-CH2-CH2-CH3 与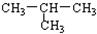 |
18.向某一固定体积的密闭容器中充入NO2,在一定条件下进行反应:2NO2?2NO+O2.达到平衡状态的标志是( )
①体系的颜色不再发生变化
②容器内压强不随时间变化而变化
③NO和O2的消耗速率之比为2:1
④容器中c(NO2):c(NO):c(O2)=2:2:1.
①体系的颜色不再发生变化
②容器内压强不随时间变化而变化
③NO和O2的消耗速率之比为2:1
④容器中c(NO2):c(NO):c(O2)=2:2:1.
| A. | ①② | B. | ③④ | C. | ①④ | D. | ②③ |
15.25℃时,下列有关CH3COOH和CH3COONa溶液关系正确的是( )
| A. | 适当加热CH3COONa溶液,c(OH-)会增大 | |
| B. | 0.10mol/L的CH3COOH溶液稀释10倍后:pH=2 | |
| C. | 0.10mol/L的CH3COONa溶液中:c(Na+)+c(H+)>c(CH3COO-)+c(CH3COOH) | |
| D. | 物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合,溶液呈酸性:c(CH3COO-)<c(CH3COOH) |
16.如图有关原子或离子的结构示意图表示正确的是( )
| A. | 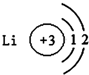 | B. | 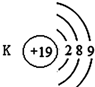 | C. | 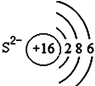 | D. | 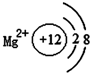 |
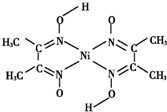 金属镍及其化合物在合金材料以及催化剂等方面应用广泛.
金属镍及其化合物在合金材料以及催化剂等方面应用广泛. 、④HCHO,其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形.
、④HCHO,其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形.
 按如图所示,两个烧杯中分别盛有足量的稀硫酸溶液和氯化铜溶液:
按如图所示,两个烧杯中分别盛有足量的稀硫酸溶液和氯化铜溶液: