题目内容
14.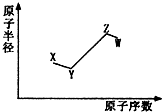 短周期非金属主族元素X、Y、Z、W,它们的原子半径与原子序数的关系如图所示.其中Z元素原子序数是Y的2倍,原子最外层电子数与X元素原子核外电子数相等,下列说法一定正确的是( )
短周期非金属主族元素X、Y、Z、W,它们的原子半径与原子序数的关系如图所示.其中Z元素原子序数是Y的2倍,原子最外层电子数与X元素原子核外电子数相等,下列说法一定正确的是( )| A. | X和Z、Y和W处于同一主族 | |
| B. | 4种元素形成的各种单质中,Z单质的沸点最高 | |
| C. | W单质与X、Y、Z的最简单氢化物都可以发生反应 | |
| D. | 元素氧化物所对应的水化物酸性:W>Z>X |
分析 由原子序数和原子半径的关系可知X、Y位于第二周期,Z、W为第三周期,Z元素原子序数是Y的2倍,Y应为O,Z为S元素,Z原子最外层电子数与X元素原子核外电子数相等,则X为C元素,W的原子序数最大,应为Cl元素,结合对应单质、化合物的性质以及元素周期率知识解答该题.
解答 解:由原子序数和原子半径的关系可知X、Y位于第二周期,Z、W为第三周期,Z元素原子序数是Y的2倍,Y应为O,Z为S元素,Z原子最外层电子数与X元素原子核外电子数相等,则X为C元素,W的原子序数最大,应为Cl元素,
A.X位于第二周期,Z位于第三周期,Y和Z位于同一主族,故A错误;
B.4种元素形成的各种单质中,X单质的沸点最高,可为金刚石或石墨,故B错误;
C.W为Cl元素,氯气与X、Y、Z的最简单氢化物甲烷、水以及硫化氢都可反应,故C正确;
D.如不是最高价氧化物的水化物,则不能比较酸性强弱,故D错误.
故选C.
点评 本题考查原子结构与元素周期律的关系,为高考常见题型和高频考点,题目难度不大,本题的关键是根据原子结构特点正确推断元素的种类.

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目
5.某研究性学习小组向一定童的NaHSO3溶液(加入少量淀粉)中加人稍过量的KIO3溶液,一段时间后.溶液突然变蓝色.为进一步研究有关因素对该反应速率的影响,探究如下.
(1)查阅资料知NaHSO3与过量KIO3反应分为两步进行,且其反应速率主要由笫一步反应决定.已知第一步反应的离子方程式为IO3-+3HSO3-=3SO42-+I-+3H+,则第二步反应的离子方程式为IO3-+5I-+6H+=3I2+3H2O.
(2)通过测定溶液变蓝所用时间来探究外界条件对该反应速率的影响,记录如下.
实验①②是探究KIO3溶液的浓度对反应速率的影响,表中t1>t2 (填“>”、“=”或“<“);
实验①③是探究温度对反应速率的影响,表中a=10.0 b=4.0
(3)将NaHSO3溶液与KIO3溶液在恒温条件下混合,用速率检测仪检测出起始阶段反应速率逐渐增大.该小组对其原因提出如下假设,请你完成假设二.
假设一:生成的SO42-对反应起催化作用;
假设二:反应生成的I-对反应起催化作用(或反应生成的H+对反应起催化作用).
(4)请你设计实验验证上述悝设一,完成下表中内容.
(1)查阅资料知NaHSO3与过量KIO3反应分为两步进行,且其反应速率主要由笫一步反应决定.已知第一步反应的离子方程式为IO3-+3HSO3-=3SO42-+I-+3H+,则第二步反应的离子方程式为IO3-+5I-+6H+=3I2+3H2O.
(2)通过测定溶液变蓝所用时间来探究外界条件对该反应速率的影响,记录如下.
| 编号 | 0.01mol/L NaHSO3溶液/mL | 0.01mol/L KIO3 溶液/mL | H2O/mL | 反应温度/ ℃ | 溶液变蓝所用 时间t/s |
| ① | 6.0 | 10.0 | 4.0 | 15 | t1 |
| ② | 6.0 | 14.0 | 0 | 15 | t2 |
| ③ | 6.0 | a | b | 25 | t3 |
实验①③是探究温度对反应速率的影响,表中a=10.0 b=4.0
(3)将NaHSO3溶液与KIO3溶液在恒温条件下混合,用速率检测仪检测出起始阶段反应速率逐渐增大.该小组对其原因提出如下假设,请你完成假设二.
假设一:生成的SO42-对反应起催化作用;
假设二:反应生成的I-对反应起催化作用(或反应生成的H+对反应起催化作用).
(4)请你设计实验验证上述悝设一,完成下表中内容.
| 实验步職(不要求写出具体搡作过程) | 预期实验现象和结论 |
| 在烧杯甲中将一定量的NaHSO3溶液与KIO3溶液混合,用速率检测仪测定起始时的反应速率v(甲); 在烧杯乙中预先加入少量Na2SO4粉末,其他条件与甲完全相同,进行同一反应, 用速率检测仪测定其起始阶段相同时间内的反应速率v(乙). | 若v(甲)=v(乙) 则假设一不成立 若v(甲)<v(乙),则假设一成立 |
2.下列说法正确的是( )
| A. | 向漂白粉中滴入60%的硫酸,产生黄绿色气体,说明硫酸具有还原性 | |
| B. | 实验室中将海带中的I-完全氧化为I2时,宜选用H2O2作氧化剂而不用HNO3 | |
| C. | 由于Ksp(BaSO4)<Ksp(BaCO3),因此BaSO4沉淀不可能转化为BaCO3沉淀 | |
| D. | 25℃时,100mLpH=13的Ba(OH)2溶液中OH-的物质的量为0.02 mol |
19.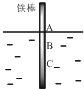 将一根较纯铁棒垂直没入水中,由于深水处溶氧量较少,一段时间后发现AB段产生较多铁锈,BC段腐蚀严重,下列关于此现象的说法错误的是( )
将一根较纯铁棒垂直没入水中,由于深水处溶氧量较少,一段时间后发现AB段产生较多铁锈,BC段腐蚀严重,下列关于此现象的说法错误的是( )
 将一根较纯铁棒垂直没入水中,由于深水处溶氧量较少,一段时间后发现AB段产生较多铁锈,BC段腐蚀严重,下列关于此现象的说法错误的是( )
将一根较纯铁棒垂直没入水中,由于深水处溶氧量较少,一段时间后发现AB段产生较多铁锈,BC段腐蚀严重,下列关于此现象的说法错误的是( )| A. | 铁棒AB段发生反应为O2+4e-+2H2O=4OH- | |
| B. | 腐蚀过程中在铁棒上会产生微电流,且方向是AB段到BC段 | |
| C. | 向水中加入一定量硫酸钾固体后,对铁棒的生锈速率几乎无影响 | |
| D. | 产生这种现象的本质原因是铁棒所处的化学环境不同 |
6.下列说法正确的是( )
| A. | CH2═CH2和CH3CH2C1都属于烃 | B. | 乙烯和乙烷都能发生加聚反应 | ||
| C. | 米酒变酸的过程涉及氧化反应 | D. | 未成熟的苹果遇碘水不会变蓝 |
 A、B、C、D、E是原子序数依次递增的短周期元素,A+无电子,BD与C2是等电子体,第一电离能:C>D>B,D和E同主族,ED2是形成酸雨的主要危害气体,F元素位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.
A、B、C、D、E是原子序数依次递增的短周期元素,A+无电子,BD与C2是等电子体,第一电离能:C>D>B,D和E同主族,ED2是形成酸雨的主要危害气体,F元素位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2. ,E属于元素周期表中ds区
,E属于元素周期表中ds区 太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质.
太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质.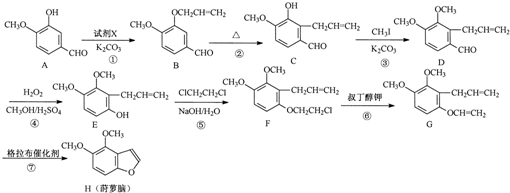
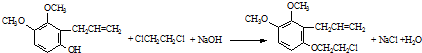 .
.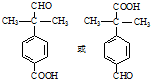 .
.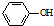 为原料制备
为原料制备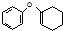 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOH}$CH3COOCH2CH3
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOH}$CH3COOCH2CH3 .
.