题目内容
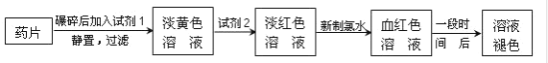
【题目】铁是人体必需的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:
试回答下列问题:
(1)试剂1是__,试剂2是__,加入新制氯水后溶液中发生的离子反应方程式是__、_____。
(2)加入试剂2后溶液中颜色由淡黄色转变为淡红色是因为__,写出+2价Fe在空气中转化为+3价Fe的化学方程式__。
(3)该同学猜想红色溶液变为无色溶液的原因是溶液中的+3价铁被还原为+2价铁,你认为该同学的猜想合理吗?__。若你认为合理,请说明理由(若你认为不合理,该空不作答);若你认为不合理请提出你的猜想并设计一个简单的实验加以验证(若你认为合理,该空不作答)___。
【答案】稀盐酸 KSCN溶液 2Fe2++Cl2=2Fe3++2Cl- Fe3++3SCN-![]() Fe(SCN)3 少量的Fe2+转化为Fe3+ 4FeCl2+O2+4HCl=4FeCl3+2H2O 不合理 猜想:Fe(SCN)3中的SCN-被过量的氯水氧化;设计的实验为在褪色后的溶液中加入FeCl3溶液,不变红色(或在褪色后的溶液中加入KSCN溶液,变红色)
Fe(SCN)3 少量的Fe2+转化为Fe3+ 4FeCl2+O2+4HCl=4FeCl3+2H2O 不合理 猜想:Fe(SCN)3中的SCN-被过量的氯水氧化;设计的实验为在褪色后的溶液中加入FeCl3溶液,不变红色(或在褪色后的溶液中加入KSCN溶液,变红色)
【解析】
(1)检验时先将药品制成溶液,以便于检验,“速力菲”药品不溶于水但能溶于人体中的胃酸,所以试剂1选用稀盐酸即可;要检验亚铁离子,需要先检验有无三价铁离子,然后检验其被氧化后生成了三价铁离子即可,故试剂2选用KSCN溶液;
(2)在加入试剂2后溶液中颜色由淡黄色转变为淡红色,说明还是有少量三价铁离子,原因是亚铁离子容易被氧化,在空气中酸性条件下可能生成少量三价铁离子,使溶液变淡红;(3)因为氯水氧化性强,三价铁离子不具备被还原的条件,因为溶液中加入的是过量氯水,Fe3+一定存在,故只可能SCN-不存在,所以结合溶液成分只能是SCN-被过量氯水氧化,检验方法可得。
(1)该药品不溶于水但能溶于人体中的胃酸,试剂1用于溶解样品,可以选用稀盐酸;试剂2用于检验三价铁离子,可以选用KSCN溶液;氯气氧化亚铁离子生成铁离子,离子方程式为:2Fe2++Cl2=2Fe3++2Cl-;铁离子与硫氰根离子结合生成硫氰化铁,离子方程式为:Fe3++3SCN-![]() Fe(SCN)3;
Fe(SCN)3;
故答案为:稀盐酸;KSCN溶液;2Fe2++Cl2=2Fe3++2Cl-;Fe3++3SCN-![]() Fe(SCN)3;
Fe(SCN)3;
(2)Fe3+遇KSCN溶液变红色,溶液由淡黄色变为浅红色,说明少量Fe2+被氧化成Fe3+;亚铁离子被空气中的氧气氧化为铁离子,化学方程式为4FeCl2+4HCl+O2=4FeCl3+2H2O;
故答案为:少量的Fe2+转化为Fe3+,加入KSCN后显淡红色;4FeCl2+4HCl+O2=4FeCl3+2H2O;
(3)因为氯水氧化性强,不会还原Fe3+,该同学的猜想不合理;可能是SCN-被过量的氯水氧化,可取少量褪色后的溶液,加入FeCl3溶液,不变红色(或取少量褪色后的溶液,加入KSCN溶液,变红色);
故答案为:不合理;猜想:Fe(SCN)3中的SCN-被过量的氯水氧化;设计的实验为取少量褪色后的溶液,加入FeCl3溶液,不变红色(或取少量褪色后的溶液,加入KSCN溶液,变红色)。

 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案