题目内容
【题目】向一定量的Mg2+、NH4+、Al3+混合溶液中加入Na2O2的量与生成沉淀和气体的量(纵坐标)的关系如图所示,则溶液中Mg2+、NH4+、Al3+三种离子的物质的量之比为( )

A.1:1:2B.2:2:1C.1:2:2D.9:2:4
【答案】C
【解析】
根据图象分析,A点时沉淀的量最大,所以沉淀是氢氧化铝和氢氧化镁,从A点到B点,沉淀的质量减少,减少的量是氢氧化铝,为0.2mol,沉淀不溶解的量是氢氧化镁,物质的量是0.1mol,根据原子守恒确定镁离子、铝离子的物质的量;当沉淀的量最大时,根据过氧化钠的物质的量计算生成氧气的物质的量,根据气体总的物质的量计算生成氨气的物质的量,根据氮原子守恒从而计算铵根离子的物质的量。
由图可知,沉淀中含0.1mol Mg(OH)2和0.2 molAl(OH)3,即原溶液中含Mg2+0.1mol,含Al3+0.2mol,Mg2++2OH-=Mg(OH)2↓,Al3++3OH-=Al(OH)3↓,沉淀2种金属阳离子共需NaOH的物质的量为0.1mol×2+0.2mol×3=0.8mol,由图中横坐标知与3种阳离子恰好完全反应时需Na2O20.5mol,而0.5molNa2O2与水反应生成1molNaOH和0.25molO2,则与铵根反应的氢氧根离子为1mol-0.8mol=0.2mol,由NH4++OH-![]() NH3↑+H2O,则可得原溶液中含0.2molNH4+,所以Mg2+、NH4+、Al3+之比=0.1mol:0.2mol:0.2mol=1:2:2;
NH3↑+H2O,则可得原溶液中含0.2molNH4+,所以Mg2+、NH4+、Al3+之比=0.1mol:0.2mol:0.2mol=1:2:2;
综上所述,C项正确;
答案选C。

 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案【题目】某研究性学习小组为了探究醋酸的电离情况,进行了如下实验:
(1)取冰醋酸配制250mL 0.4 mol·L-1的醋酸溶液,用0.4mol·L-1的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定。回答下列问题:
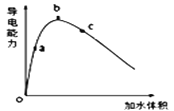
①将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示。则稀释过程中溶液的pH由大到小的顺序____(填字母)。
②为标定该醋酸溶液的准确浓度,用0.2000mol·L-1的NaOH溶液对20.00mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
实验序号 | 1 | 2 | 3 | 4 |
消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
该醋酸溶液的准确浓度为_____________(保留小数点后四位),上述标定过程中,造成测定结果偏高的原因可能是_____________(多选、错选不得分)。
a.未用标准液润洗碱式滴定管
b.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
c.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
d.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
(2)该小组同学探究浓度对醋酸电离程度的影响时,用pH计测定25℃时不同浓度的醋酸的pH,其结果如下:
醋酸浓度( mol·L-1) | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
①根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是___________。
②简述用pH试纸测 0.1mol·L-1 醋酸溶液pH的方法___________。