题目内容
【题目】研究氮氧化物的反应机理,对于消除其对环境的污染具有重要意义。
(1)升高温度,绝大多数的化学反应速率增大,但是![]() 的反应速率却随着温度的升高而减小。查阅资料得知,该反应历程分为以下两步:
的反应速率却随着温度的升高而减小。查阅资料得知,该反应历程分为以下两步:
Ⅰ.![]() (快)
(快) ![]()
![]() 正
正![]() 正
正![]()
![]() 逆
逆![]() 逆
逆![]()
Ⅱ.![]() (慢)
(慢) ![]()
![]() 正
正![]() 正
正![]()
![]() 逆
逆![]() 逆
逆![]()
回答:
①反应![]() 的
的![]() ____(用含
____(用含![]() 和
和![]() 的式子表示)。一定温度下,反应
的式子表示)。一定温度下,反应![]() 达到平衡状态,写出用
达到平衡状态,写出用![]() 正、
正、![]() 逆、
逆、![]() 正、
正、![]() 逆表示的平衡常数表达式
逆表示的平衡常数表达式![]() ____。
____。
②决定![]() 反应速率的是反应Ⅱ,则反应Ⅰ的活化能
反应速率的是反应Ⅱ,则反应Ⅰ的活化能![]() 与反应Ⅱ的活化能
与反应Ⅱ的活化能![]() 的大小关系为
的大小关系为![]() ____
____![]() (填“
(填“![]() ”“
”“![]() ”或“
”或“![]() ”)。
”)。
(2)亚硝酸氯(![]() )是有机合成中重要的试剂,可
)是有机合成中重要的试剂,可![]() 与
与![]() 在一定条件下合成。在
在一定条件下合成。在![]() 容器恒温条件下,将物质的量之和为
容器恒温条件下,将物质的量之和为![]() 的
的![]() 和
和![]() 以不同的氮氯比进行如下反应:
以不同的氮氯比进行如下反应:![]()
![]() ,平衡时某反应物的转化率与氮氯比及不同温度的关系结果如下图。
,平衡时某反应物的转化率与氮氯比及不同温度的关系结果如下图。
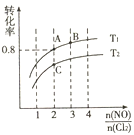
①判断图中温度![]() 、
、![]() 的关系:
的关系:![]() ____
____![]() 。(填“
。(填“![]() ”、“
”、“![]() ”或“
”或“![]() ”)
”)
②图中纵坐标为物质____(填化学式)的转化率,理由是_____。
③图中![]() 、
、![]() 、
、![]() 三点中平衡时
三点中平衡时![]() 体积分数最大的是____。(填“
体积分数最大的是____。(填“![]() ”、“
”、“![]() ”或“
”或“![]() ”)
”)
④![]() 温度下,该反应的平衡常数
温度下,该反应的平衡常数![]() ____。
____。
【答案】![]()
![]()
![]()
![]()
![]() 当
当![]() 升高,反应物转化率大
升高,反应物转化率大 ![]() 160
160
【解析】
(1)①运用盖斯定律,将方程式叠加,就可以得到相应反应的热化学方程式;根据反应达到平衡时正、逆反应速率相等,结合速率与物质浓度关系,可得K的表达式;再利用温度对化学平衡的影响,分析温度与化学平衡常数的关系;
②根据活化能高反应速率慢,活化能低化学反应速率快,比较二者活化能的大小;然后利用温度对化学平衡移动的影响,结合物质浓度的变化,确定物质的位置;
(2)①2NO(g)+Cl2(g)2NOCl(g)△H<0.反应为放热反应,升温平衡逆向进行,结合图象变化分析判断;
②NO和Cl2以不同的氮氯比反应,图象中转化率随比值增大而增大,两种反应物增加一种会提高另一种的转化率;
③方程式中NO和Cl2的系数比为2:1,按照此反应比,氯气转化率最大时得到产物的体积分数最大;
④结合三行计算列式计算A点平衡常数,温度不变平衡常数不变。
(1) ①I .2NO(g) N2O2(g) △H1<0;II.N2O2(g)+O2(g) ![]() 2NO2(g) △H2<0,I+II可得:2NO(g) +O2(g) 2NO2(g) △H=△H1+△H2;
2NO2(g) △H2<0,I+II可得:2NO(g) +O2(g) 2NO2(g) △H=△H1+△H2;
当该反应达到平衡时,V1正=V1逆,V2正=V2逆,所以V1正×V2正=V1逆×V2逆,即k1正c2(NO)×K2正c(N2O2)×c(O2)= k1逆c(N2O2)×K2逆c2(NO2)×c(O2),则是K=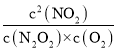 =
=![]() ;
;
②2NO(g) +O2(g) 2NO2(g)反应的快慢由反应速率慢的反应II决定,所以反应的活化能E1<E2;
(2) ①2NO(g)+Cl2(g)2NOCl(g)△H<0.反应为放热反应,升温平衡逆向进行,一定氮氯比条件下,升温平衡逆向进行,反应物平衡转化率减小,则T1<T2;
②保持恒温恒容条件,将物质的量之和为3mol的NO和Cl2以不同的氮氯比(![]() )进行反应,平衡时某反应物的转化率与氮氯比及不同温度的关系如图所示,
)进行反应,平衡时某反应物的转化率与氮氯比及不同温度的关系如图所示,![]() 越大,相当于增加NO的量,此时转化率越大,说明纵轴表示的是氯气的转化率,故答案为:Cl2;
越大,相当于增加NO的量,此时转化率越大,说明纵轴表示的是氯气的转化率,故答案为:Cl2;![]() 增加时氯气转化率增大;
增加时氯气转化率增大;
③方程式中NO和Cl2的系数比为2:1,按照此反应比,氯气转化率最大时得到产物的体积分数最大,图中A、B、C三点对应的NOCl体积分数最大的是:A,故答案为:A;
④2NO(g)+Cl2(g)2NOCl(g)△H<0.保持恒温恒容条件,将物质的量之和为3mol的NO和Cl2以不同的氮氯比(![]() )进行反应,A点氯气转化率为0.8,
)进行反应,A点氯气转化率为0.8,![]() =2,体积为2L,结合三行计算列式计算,
=2,体积为2L,结合三行计算列式计算,
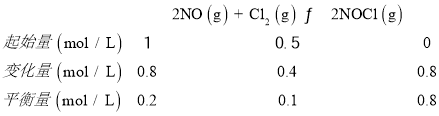
平衡常数 K=![]() =160,故答案为:160。
=160,故答案为:160。