题目内容
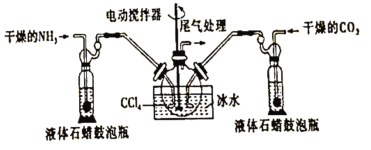
【题目】氨基甲酸铵(![]() )是一种白色固体,易分解、易水解,可用作肥料、灭火剂、洗涤剂等。某化学兴趣小组用如下仪器模拟制备氨基甲酸铵,已知该制备反应为放热反应。制备氨基甲酸铵的装置如图所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。
)是一种白色固体,易分解、易水解,可用作肥料、灭火剂、洗涤剂等。某化学兴趣小组用如下仪器模拟制备氨基甲酸铵,已知该制备反应为放热反应。制备氨基甲酸铵的装置如图所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。
(1)制备氨基甲酸铵的化学方程式为____________
(2)三颈烧瓶用冰水冷却的原因是______________
(3)液体石蜡鼓泡瓶的作用是_______________
(4)水是很好的溶剂,且可以大量吸收反应混合气体,该反应中是否可用水作溶剂:________(填“是”或“否”),理由:___________
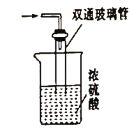
(5)尾气处理装置如图所示,双通玻璃管的作用是_________,浓硫酸的作用是________
(6)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品0.7820 g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得其质量为1.00 g。则样品中氨基甲酸铵的质量分数为________
【答案】2NH3+CO2==NH2COONH4 降温,提高反应转化率(或降温,防止生成物分解) 观察气泡产生的速率,据此调节通入气体的比例 否 产物易水解 防止倒吸 吸收未反应的氨气,且避免水蒸气进入反应器中 80%
【解析】
把氨气和二氧化碳通入四氯化碳中,发生反应2NH3+CO2==NH2COONH4,由于反应放热,所以需将反应在低温下进行,以有利于提高反应物的转化率;从方程式中可以看出,参加反应的NH3与CO2的体积比为2:1,所以需设法控制气体的进入量;因为NH2COONH4易水解,所以两种反应物必须干燥,且吸收尾气的装置中也不能有水蒸气产生。计算样品中氨基甲酸铵的质量分数时,可先求出生成CaCO3的物质的量,再列方程,求出样品中所含NH2COONH4的物质的量,从而求出其质量及质量分数。据此回答题中各问。
(1)把氨气和二氧化碳通入四氯化碳中,可反应制得氨基甲酸铵,化学方程式为2NH3+CO2==NH2COONH4。答案为:2NH3+CO2==NH2COONH4;
(2)由于反应放热,所以需将反应在低温下进行,以有利于提高反应物的转化率,从而得出三颈烧瓶用冰水冷却的原因是降温,提高反应转化率(或降温,防止生成物分解)。答案为:降温,提高反应转化率(或降温,防止生成物分解);
(3)从方程式中可以看出,参加反应的NH3与CO2的体积比为2:1,所以需设法控制气体的进入量,由此得出液体石蜡鼓泡瓶的作用是观察气泡产生的速率,据此调节通入气体的比例。答案为:观察气泡产生的速率,据此调节通入气体的比例;
(4)由信息可知,NH2COONH4遇水易发生水解,所以该反应中不可用水作溶剂,理由:产物易水解。答案为:否;产物易水解;
(5)因为氨气极易溶于水,所以吸收尾气时,需注意防止倒吸,同时防止产生水蒸气进入反应容器,从而引起NH2COONH4的水解,所以双通玻璃管的作用是防止倒吸,浓硫酸的作用是吸收未反应的氨气,且避免水蒸气进入反应器中。答案为:防止倒吸;吸收未反应的氨气,且避免水蒸气进入反应器中;
(6)n(CaCO3)=![]() =0.01mol,设样品NH2COONH4的物质的量为x,则碳酸氢铵的物质的量为0.01-x,依题意可建立如下关系式:79(0.01-x)+78x=0.7820,从而求出x=0.08mol,则样品中氨基甲酸铵的质量分数为
=0.01mol,设样品NH2COONH4的物质的量为x,则碳酸氢铵的物质的量为0.01-x,依题意可建立如下关系式:79(0.01-x)+78x=0.7820,从而求出x=0.08mol,则样品中氨基甲酸铵的质量分数为![]() ≈80%。答案为:80%。
≈80%。答案为:80%。