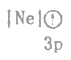题目内容
【题目】氮、磷、砷(As)、锑(Sb)、铋(Bi)、镆(Mc)为元素周期表中原子序数依次增大的同族元素。回答下列问题:
(1)砷在元素周期表中的位置______。![]() 的中子数为________。
的中子数为________。
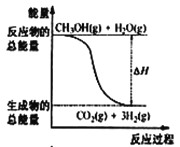
已知:P(s,白磷)=P(s,黑磷) ΔH=-39.3 kJ·mol-1;P(s,白磷)=P(s,红磷) ΔH=-17.6 kJ·mol-1;由此推知,其中最稳定的磷单质是________。
(2)氮和磷氢化物性质的比较:热稳定性:NH3________PH3(填“>”或“<”)。沸点:N2H4________P2H4(填“>”或“<”),判断依据是____________。
【答案】第四周期ⅤA族 173 黑磷 > > N2H4分子间存在氢键
【解析】
(1)As位于第四周期第VA族,中子数=质量数-质子数;能量越低越稳定;
(2)元素的非金属性越强,其氢化物越稳定;分子晶体熔沸点与分子间作用力和氢键有关,能形成分子间氢键的氢化物熔沸点较高。
(1)As位于第四周期第VA族,中子数=质量数-质子数=288-115=173;
能量越低越稳定,
P(s,白磷)=P(s,黑磷) ΔH=-39.3 kJ·mol-1①
P(s,白磷)=P(s,红磷)ΔH=-17.6 kJ·mol-1②
将方程式①-②得![]() ,
,
则能量:红磷>黑磷,则黑磷稳定,
故答案为:第四周期第VA族;173;黑磷;
(2)元素的非金属性越强,其氢化物越稳定;
非金属性N>P,所以热稳定性:NH3>PH3;
N2H4能形成分子间氢键、P2H4分子间不能形成氢键,所以沸点:N2H4>P2H4,
故答案为:>;>;N2H4分子间存在氢键。

练习册系列答案
 学业测评一课一测系列答案
学业测评一课一测系列答案
相关题目