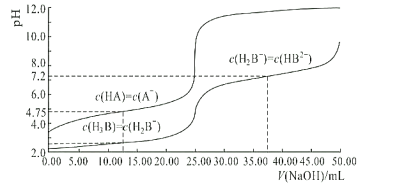
题目内容
【题目】“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效开发利用CO2,已引起全世界的普遍重视。一定条件下,CO2可以转化为甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。
(1)在一恒温恒容密闭容器中充入1molCO2和3molH2进行上述反应。测得CO2(g)和CH3OH(g)浓度随时间变化如图所示。
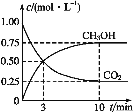
①0~10min内,氢气的平均反应速率为___,第10min后,保持温度不变,向该密闭容器中再充入1molCO2(g)和1molH2O(g),则平衡___(填“正向”“逆向”或“不”)移动。
②若已知:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-akJ·mol-1;
CH3OH(g)+H2O(g) ΔH=-akJ·mol-1;
2H2(g)+ O2(g)=2H2O(g) ΔH=-bkJ·mol-1
H2O(g)=H2O(l) ΔH=-ckJ·mol-1;
CH3OH(g)=CH3OH(l) ΔH=-dkJ·mol-1。
则表示CH3OH(l)燃烧热的热化学方程为___。
(2)如图所示,25℃时以甲醇燃料电池(电解质溶液为稀硫酸)为电源电解600mL一定浓度的NaCl溶液,电池的正极反应式为___。在电解一段时间后,NaCl溶液的pH变为12(假设电解前后NaCl溶液的体积不变),则理论上消耗甲醇的物质的量为___mol。
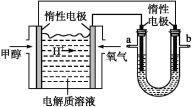
(3)向(2)电解后U形管的溶液中通入标准状况下89.6mL的CO2气体,则所得溶液呈___ (填“酸”“碱”或“中”)性,溶液中各离子浓度由大到小的顺序为___。
【答案】0.225mol·L-1·min-1 正向 CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) ΔH=-(
O2(g)=CO2(g)+2H2O(l) ΔH=-(![]() b+2c-a-d)kJ·mol-1 O2+4e-+4H+=2H2O 0.001 碱 c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
b+2c-a-d)kJ·mol-1 O2+4e-+4H+=2H2O 0.001 碱 c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
【解析】
(1)①利用![]() 计算反应速率;根据Q、K的关系判断平衡移动方向;
计算反应速率;根据Q、K的关系判断平衡移动方向;
②利用盖斯定律计算CH3OH(l)的燃烧热;
(2)燃料电池的正极是氧气得电子发生还原反应;根据得失电子守恒计算消耗甲醇的物质的量;
(3)根据(2)中生成氢氧化钠的物质的量计算通入标准状况下89.6mL的CO2气体后溶质的物质的量,再判断离子浓度。
(1)①由图示可知甲醇的浓度在10min内增加0.75mol·L-1,所以氢气浓度减少3×0.75mol·L-1,10min内氢气的平均反应速率为![]() 0.225mol·L-1·min-1;在一恒温恒容密闭容器中充入1molCO2,起始时CO2的浓度是1mol·L-1,可知容器的体积是1L,则
0.225mol·L-1·min-1;在一恒温恒容密闭容器中充入1molCO2,起始时CO2的浓度是1mol·L-1,可知容器的体积是1L,则
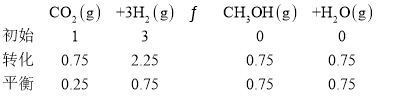
K=![]() ;
;
向该密闭容器中再充入1molCO2(g)和1molH2O(g),此时反应的浓度商=![]() ,平衡正向移动;
,平衡正向移动;
②Ⅰ CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-akJ·mol-1;
CH3OH(g)+H2O(g) ΔH=-akJ·mol-1;
Ⅱ 2H2(g)+ O2(g)= 2H2O(g) ΔH=-bkJ·mol-1
Ⅲ H2O(g)=H2O(l) ΔH=-ckJ·mol-1;
Ⅳ CH3OH(g)=CH3OH(l) ΔH=-dkJ·mol-1;
根据盖斯定律,Ⅱ×![]() +Ⅲ×2-Ⅳ-Ⅰ得CH3OH(l)+
+Ⅲ×2-Ⅳ-Ⅰ得CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) ΔH=-(
O2(g)=CO2(g)+2H2O(l) ΔH=-(![]() b+2c-a-d)kJ·mol-1;
b+2c-a-d)kJ·mol-1;
(2)正极发生还原反应,氧气得电子结合氢离子生成水,电极反应式为O2+4e-+4H+=2H2O;电解氯化钠溶液生成氢氧化钠,电解一段时间后pH=12,![]() mol/L,n(OH-)=10-2 mol/L×0.6L=0.006mol,根据阴极反应
mol/L,n(OH-)=10-2 mol/L×0.6L=0.006mol,根据阴极反应![]() ,所以转移电子0.006mol,每消耗1mol甲醇转移电子数目为6mol,利用得失电子守恒,可知消耗甲醇的物质的量为0.001mol。
,所以转移电子0.006mol,每消耗1mol甲醇转移电子数目为6mol,利用得失电子守恒,可知消耗甲醇的物质的量为0.001mol。
(3)根据(2),电解过程中U形管中生成氢氧化钠的物质的量是0.006mol,通入0.0896L÷22.4L/mol=0.004molCO2后,得到等浓度的Na2CO3和NaHCO3的混合溶液,所以溶液呈碱性;![]() 的水解程度大于
的水解程度大于![]() 的水解程度,所以溶液中各离子浓度的大小关系为c(Na+)>c(
的水解程度,所以溶液中各离子浓度的大小关系为c(Na+)>c(![]() )>c(
)>c(![]() )>c(OH-)>>(H+)。
)>c(OH-)>>(H+)。

 一线名师提优试卷系列答案
一线名师提优试卷系列答案【题目】用H2O2、KI和洗洁精可完成“大象牙膏”实验(短时间内产生大量泡沫),某同学依据文献资料对该实验进行探究。
(1)资料1:KI在该反应中的作用:
H2O2+I-=H2O+IO-;H2O2+IO-=H2O+O2↑+I-。总反应的化学方程式是________________。
(2)资料2:H2O2分解反应过程中能量变化如图所示,其中①有KI加入,②无KI加入。下列判断正确的是___________(填字母)。
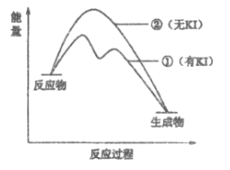
a. 加入KI后改变了反应的路径
b. 加入KI后改变了总反应的能量变化
c. H2O2+I-=H2O+IO-是放热反应
(3)实验中发现,H2O2与KI溶液混合后,产生大量气泡,溶液颜色变黄。再加入CCl4,振荡、静置,气泡明显减少。
资料3:I2也可催化H2O2的分解反应。
①加CCl4并振荡、静置后还可观察到___________,说明有I2生成。
②气泡明显减少的原因可能是:i. H2O2浓度降低;ii. ________。以下对照实验说明i不是主要原因:向H2O2溶液中加入KI溶液,待溶液变黄后,分成两等份于A、B两试管中。A试管加入CCl4,B试管不加CCl4,分别振荡、静置。观察到的现象是_____________。
(4)资料4:I-(aq)+I2(aq)![]() I3-(aq) K=640。
I3-(aq) K=640。
为了探究体系中含碘微粒的存在形式,进行实验:向20 mL一定浓度的H2O2溶液中加入10mL 0.10mol·L-1 KI溶液,达平衡后,相关微粒浓度如下:
微粒 | I- | I2 | I3- |
浓度/(mol·L-1) | 2.5×10-3 | a | 4.0×10-3 |
①a=__________。
②该平衡体系中除了含有I-,I2,I3-外,一定还含有其他含碘微粒,理由是________________。
【题目】室温下,将0.05 mol Na2CO3固体溶于水配成100 mL溶液,向溶液中加入下列物质,有关结论正确的是( )
加入物质 | 结论 | |
A | 50 mL 1 mol·L-1H2SO4 | 反应结束后,c(Na+)=c(SO |
B | 0.05 mol CaO | 溶液中 |
C | 50 mL H2O | 由水电离出的c(H+)·c(OH-)不变 |
D | 0.1 mol NaHSO4固体 | 反应完全后,溶液pH减小,c(Na+)不变 |
A. A B. B C. C D. D