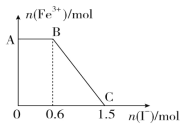
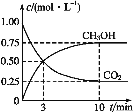
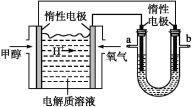
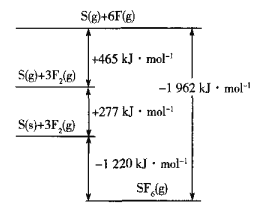
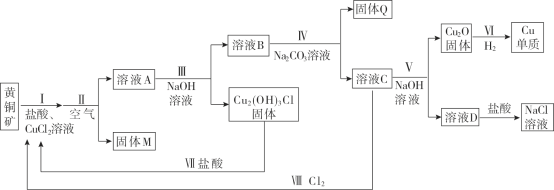
题目内容
【题目】某有机物A a g完全燃烧后通过足量的Na2O2,固体质量增重也是a g,则有机物可能是
①H2 ②CO ③CH3OH ④HCHO ⑤CH3COOCH3 ⑥C6H12O6 ⑦CH3CH2OH ⑧CH3CH2CH3 ⑨![]() ⑩
⑩![]()
A.①②B.⑤⑦⑧
C.④⑤⑨⑩D.③④⑥⑩
【答案】D
【解析】
由2H2+O2![]() 2H2O,2H2O+2Na2O2=4NaOH+O2
2H2O,2H2O+2Na2O2=4NaOH+O2![]() ,知当H2完全燃烧后通过足量的Na2O2,固体质量增重即为H2的质量,用方程式表示,相当于H2+Na2O2=2NaOH,同样得到CO+Na2O2=Na2CO3,故当原物质的组成相当于H2或CO时,完全燃烧后固体的增加量即为有机物的质量,③可写为:CO·(H2)2,④可写为:CO·H2,⑥可写为:(CO)6·(H2)6,⑩可写为:(CO)3·(H2)3,而其它物质不符合题意,故答案选D。
,知当H2完全燃烧后通过足量的Na2O2,固体质量增重即为H2的质量,用方程式表示,相当于H2+Na2O2=2NaOH,同样得到CO+Na2O2=Na2CO3,故当原物质的组成相当于H2或CO时,完全燃烧后固体的增加量即为有机物的质量,③可写为:CO·(H2)2,④可写为:CO·H2,⑥可写为:(CO)6·(H2)6,⑩可写为:(CO)3·(H2)3,而其它物质不符合题意,故答案选D。

【题目】氧化白藜芦醇W具有抗病毒等作用。下面是利用Heck反应合成W的一种方法:
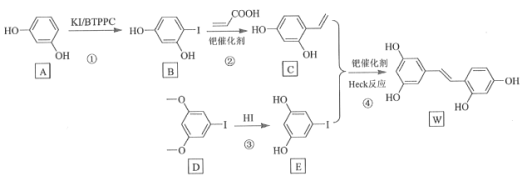
回答下列问题:
![]() 的化学名称为___________。
的化学名称为___________。
![]()
![]() 中的官能团名称是___________。
中的官能团名称是___________。
![]() 反应③的类型为___________,W的分子式为___________。
反应③的类型为___________,W的分子式为___________。
![]() 不同条件对反应④产率的影响见下表:
不同条件对反应④产率的影响见下表:
实验 | 碱 | 溶剂 | 催化剂 | 产率 |
1 | KOH | DMF |
|
|
2 |
| DMF |
|
|
3 |
| DMF |
|
|
4 | 六氢吡啶 | DMF |
|
|
5 | 六氢吡啶 | DMA |
|
|
6 | 六氢吡啶 | NMP |
|
|
上述实验探究了________和________对反应产率的影响。此外,还可以进一步探究________等对反应产率的影响。
![]() 为D的同分异构体,写出满足如下条件的X的结构简式________________。
为D的同分异构体,写出满足如下条件的X的结构简式________________。
含有苯环;②有三种不同化学环境的氢,个数比为6:2:1;③1 mol的X与足量金属Na反应可生成2 g H2。