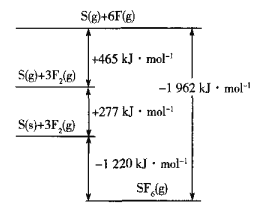
题目内容
【题目】砷酸(H3AsO4)分步电离的平衡常数(25℃)为:K1=5.6×10-3,K2=1.7×10-7,K3=4.0×10-12,第三步电离的平衡常数的表达式为K3=________;Na3AsO4的第一步水解的离子方程式为:AsO43-+H2O![]() HAsO42-+OH-,该步水解的平衡常数(25℃)为_________________。
HAsO42-+OH-,该步水解的平衡常数(25℃)为_________________。
【答案】![]() 2.5×10-3
2.5×10-3
【解析】
H3AsO4的第三步电离方程式为HAsO42-AsO43-+H+,据此写出第三步电离平衡常数的表达式;依据水解常数与电离常数及Kw的关系计算水解常数。
砷酸(H3AsO4)的第三步电离方程式为HAsO42-AsO43-+H+,则其第三步电离平衡常数的表达式为![]() ;Na3AsO4的第一步水解的离子方程式为:AsO43-+H2O
;Na3AsO4的第一步水解的离子方程式为:AsO43-+H2O![]() HAsO42-+OH-,则该步水解的平衡常数(25℃)为
HAsO42-+OH-,则该步水解的平衡常数(25℃)为![]() ,故答案为:
,故答案为:![]() ;2.5×10-3。
;2.5×10-3。

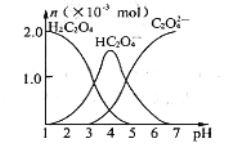
【题目】人体血液里存在重要的酸碱平衡:![]() ,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随
,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随![]() 变化关系如下表:
变化关系如下表:
| 1.0 | 17.8 | 20.0 | 22.4 |
pH | 6.10 | 7.35 | 7.40 | 7.45 |
下列说法不正确的是
A. 正常人体血液中, ![]() 的水解程度大于电离程度
的水解程度大于电离程度
B. 人体血液酸中毒时,可注射![]() 溶液缓解
溶液缓解
C. ![]() 的血液中,
的血液中, ![]()
D. pH=7.40的血液中, ![]() 的水解程度一定大于
的水解程度一定大于![]() 的电离程度
的电离程度
【题目】氧化白藜芦醇W具有抗病毒等作用。下面是利用Heck反应合成W的一种方法:
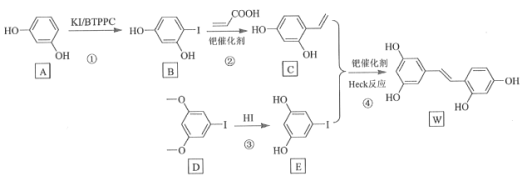
回答下列问题:
![]() 的化学名称为___________。
的化学名称为___________。
![]()
![]() 中的官能团名称是___________。
中的官能团名称是___________。
![]() 反应③的类型为___________,W的分子式为___________。
反应③的类型为___________,W的分子式为___________。
![]() 不同条件对反应④产率的影响见下表:
不同条件对反应④产率的影响见下表:
实验 | 碱 | 溶剂 | 催化剂 | 产率 |
1 | KOH | DMF |
|
|
2 |
| DMF |
|
|
3 |
| DMF |
|
|
4 | 六氢吡啶 | DMF |
|
|
5 | 六氢吡啶 | DMA |
|
|
6 | 六氢吡啶 | NMP |
|
|
上述实验探究了________和________对反应产率的影响。此外,还可以进一步探究________等对反应产率的影响。
![]() 为D的同分异构体,写出满足如下条件的X的结构简式________________。
为D的同分异构体,写出满足如下条件的X的结构简式________________。
含有苯环;②有三种不同化学环境的氢,个数比为6:2:1;③1 mol的X与足量金属Na反应可生成2 g H2。