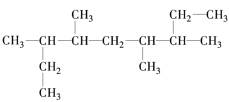
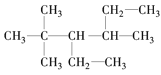
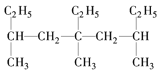
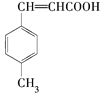
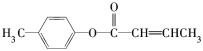
题目内容
【题目】水的电离平衡曲线如图所示,下列说法不正确的是
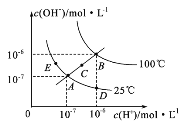
A.图中五点Kw间的关系:B>C>A=D=E
B.若从A点到D点,可采用在水中加入少量酸的方法
C.若从A点到C点,可采用温度不变时在水中加入适量HCl溶液的方法
D.若处在B点时,将pH=2的硫酸与pH=10的KOH等体积混合后,溶液显中性
【答案】C
【解析】
A. 水的电离过程是吸热过程,温度越高,电离程度越大,电离产生的离子浓度越大,Kw越大,同一温度下的Kw相同。A、D、E都处于25℃时,Kw相等,温度B点>C点,c(H+)和c(OH-)越大,Kw越大,故图中五点Kw间的关系:B>C>A=D=E,A正确;
B. 从A点到D点,溶液中c(H+)增大,而c(OH-)减小,由于温度不变,所以采取的措施是向水中加入少量酸,B正确;
C. 若从A点到C点,c(H+)和c(OH-)都变大,Kw也增大,只能采取升高温度的方法,C错误;
D. 若处在B点时,pH=2的硫酸,c(H+)=10-2 mol/L,pH=10的KOH中c(OH-)=10-2 mol/L,二者等体积混合时,恰好发生中和反应,溶液显中性,D正确;
故合理选项是C。

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案
相关题目