题目内容
【题目】下列有关说法正确的是
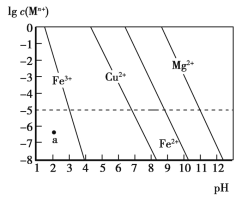
A.天然弱碱水呈碱性的原因是其中含有较多的Mg2+、Ca2+等离子
B.生活中用电解食盐水的方法制取消毒液,运用了盐类水解的原理
C.向CuCl2溶液中加入CaCO3,调节pH可除去溶液中混有的Fe3+
D.焊接时用NH4Cl溶液除锈与盐类水解有关
【答案】D
【解析】
A.天然水呈弱碱性,是因为天然水中有弱酸根离子如CO32-或HCO3-,它们水解使水呈弱碱性,不能含较多的Mg2+、Ca2+等离子,A错误;
B.生活中用电解食盐水的方法制取消毒液是由于在电解时发生反应:2NaCl+2H2O![]() Cl2↑+H2↑+2NaOH,反应产生Cl2与NaOH反应产生NaCl、NaClO,NaClO具有强氧化性,具有杀菌消毒作用,B错误;
Cl2↑+H2↑+2NaOH,反应产生Cl2与NaOH反应产生NaCl、NaClO,NaClO具有强氧化性,具有杀菌消毒作用,B错误;
C. Fe3++3H2O![]() Fe(OH)3+3H+,加入CaCO3消耗H+,使水解平衡向右移动,可除去Fe3+,但同时又引入新杂质Ca2+,不能达到除杂的目的,C错误;
Fe(OH)3+3H+,加入CaCO3消耗H+,使水解平衡向右移动,可除去Fe3+,但同时又引入新杂质Ca2+,不能达到除杂的目的,C错误;
D. 因为NH4Cl是强酸弱碱盐,NH4+发生盐类水解反应:NH4++H2O![]() NH3.H2O+H+,水解生成的H+与铁锈反应,因此可以除锈,与盐类水解有关,D正确;
NH3.H2O+H+,水解生成的H+与铁锈反应,因此可以除锈,与盐类水解有关,D正确;
故合理选项是D。

【题目】人体血液里存在重要的酸碱平衡:![]() ,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随
,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随![]() 变化关系如下表:
变化关系如下表:
| 1.0 | 17.8 | 20.0 | 22.4 |
pH | 6.10 | 7.35 | 7.40 | 7.45 |
下列说法不正确的是
A. 正常人体血液中, ![]() 的水解程度大于电离程度
的水解程度大于电离程度
B. 人体血液酸中毒时,可注射![]() 溶液缓解
溶液缓解
C. ![]() 的血液中,
的血液中, ![]()
D. pH=7.40的血液中, ![]() 的水解程度一定大于
的水解程度一定大于![]() 的电离程度
的电离程度
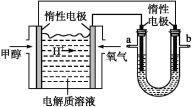
【题目】某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图1)。从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化。
(1)请完成以下实验设计表(表中不要留空格):
编号 | 实验目的 | 碳粉/g | 铁粉/g | 醋酸/% |
① | 为以下实验作参照 | 0.5 | 2.0 | 90.0 |
② | 醋酸浓度的影响 | 0.5 | __ | 36.0 |
③ | __ | 0.2 | 2.0 | 90.0 |
(2)编号①实验测得容器中压强随时间变化如图2。t2时,容器中压强明显小于起始压强,其原因是铁发生了_____________腐蚀,请在图3中用箭头标出发生该腐蚀时电子流动方向;此时,碳粉表面发生了__(“氧化”或“还原”)反应,其电极反应式是___________________________________。
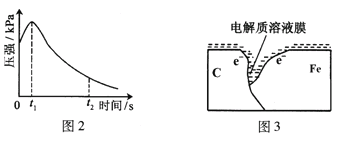
(3)该小组对图2中0~t1时压强变大的原因提出了如下假设,请你完成假设二:
假设一:发生析氢腐蚀产生了气体;
假设二:______________________________;
……
(4)为验证假设一,某同学设计了检验收集的气体中是否含有H2的方案。请你再设计一个实验方案验证假设一,写出实验步骤和结论。
实验步骤和结论(不要求写具体操作过程):__________
【题目】氧化白藜芦醇W具有抗病毒等作用。下面是利用Heck反应合成W的一种方法:
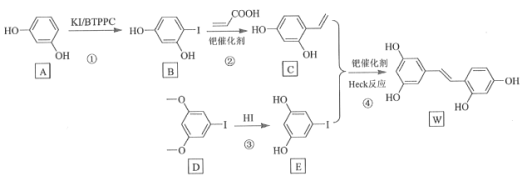
回答下列问题:
![]() 的化学名称为___________。
的化学名称为___________。
![]()
![]() 中的官能团名称是___________。
中的官能团名称是___________。
![]() 反应③的类型为___________,W的分子式为___________。
反应③的类型为___________,W的分子式为___________。
![]() 不同条件对反应④产率的影响见下表:
不同条件对反应④产率的影响见下表:
实验 | 碱 | 溶剂 | 催化剂 | 产率 |
1 | KOH | DMF |
|
|
2 |
| DMF |
|
|
3 |
| DMF |
|
|
4 | 六氢吡啶 | DMF |
|
|
5 | 六氢吡啶 | DMA |
|
|
6 | 六氢吡啶 | NMP |
|
|
上述实验探究了________和________对反应产率的影响。此外,还可以进一步探究________等对反应产率的影响。
![]() 为D的同分异构体,写出满足如下条件的X的结构简式________________。
为D的同分异构体,写出满足如下条件的X的结构简式________________。
含有苯环;②有三种不同化学环境的氢,个数比为6:2:1;③1 mol的X与足量金属Na反应可生成2 g H2。