题目内容
6.Na2CO3固体中混有少量NaHCO3,除去的方法是加热,反应的化学方程式为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑;NaHCO3溶液中含有少量Na2CO3,除去的方法是通入过量CO2,反应的离子方程式为CO32-+H2O+CO2═2HCO3-.分析 碳酸氢钠不稳定,加热易分解,碳酸钠可与水、二氧化碳反应生成碳酸氢钠,以此解答.
解答 解:碳酸氢钠不稳定,加热易分解,则Na2CO3固体中混有少量NaHCO3,可用加热的方法分离,发生2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,碳酸钠可与水、二氧化碳反应生成碳酸氢钠,NaHCO3溶液中混有少量Na2CO3,除去杂质可用通入过量CO2的方法,反应的离子方程式为CO32-+H2O+CO2═2HCO3-,故答案为:加热;2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑;通入过量CO2;CO32-+H2O+CO2═2HCO3-.
点评 本题考查碳酸钠和碳酸氢钠的性质,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质的异同,根据性质选择分离方法,难度不大,注意相关基础知识的积累.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
16.完全燃烧物质的量相等的某有机物和乙醇,实验测得:
①乙醇燃烧生成的CO2的量是该有机物燃烧生成的CO2的量的$\frac{2}{3}$;
②该有机物燃烧生成水的量是乙醇燃烧生成水的量的$\frac{2}{3}$;
③二者消耗相同状态下氧气的体积相同,通过分析判断该有机物是( )
①乙醇燃烧生成的CO2的量是该有机物燃烧生成的CO2的量的$\frac{2}{3}$;
②该有机物燃烧生成水的量是乙醇燃烧生成水的量的$\frac{2}{3}$;
③二者消耗相同状态下氧气的体积相同,通过分析判断该有机物是( )
| A. | C4H9OH | B. | CH2=CHCOOH | C. | CH2=CHCHO | D. | CH3CH2COOH |
17.下列有关表示方法中,正确的是( )
| A. | 次氯酸的电子式为: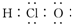 | |
| B. | 氮原子轨道表示式为: | |
| C. | 硫原子的最外层电子排布式为:3s23p4 | |
| D. | N2的结构式为::N≡N: |
14.下列不属于烃类物质的是( )
| A. | C6H6 | B. | C2H4 | C. | C2H5OH | D. | C3H4 |
1.你留意过标签上的化学吗?这是某品牌休闲西服标签上的部分内容:
回答:(1)其中属于合成纤维的是绦纶
(2)从此标签中可感觉羊毛、绦纶两种纤维的共同点有不耐高温、有可燃性.
(3)将面料、里料中各抽出一根来点燃,可观察到的现象是羊毛灼烧时有烧焦羽毛的气味,而绦纶无此现象.
| 等级:特级 成份:面料 羊毛80% 绦纶20% 里料 绦纶100% |  |
| 熨烫标准:中温,不超过150℃ |
(2)从此标签中可感觉羊毛、绦纶两种纤维的共同点有不耐高温、有可燃性.
(3)将面料、里料中各抽出一根来点燃,可观察到的现象是羊毛灼烧时有烧焦羽毛的气味,而绦纶无此现象.
18.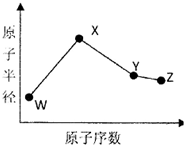 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为14,中子数为7;X的离子与NH4+具有相同的质子、电子数目:W与Y的氧化物均能导致酸雨的形成;Z的非会属性在同周期主族元素中最强.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为14,中子数为7;X的离子与NH4+具有相同的质子、电子数目:W与Y的氧化物均能导致酸雨的形成;Z的非会属性在同周期主族元素中最强.
(1)Y在周期表中的位置是第三周期第ⅥA族.
(2)用电子式表示化合物X3W的结构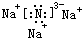 .
.
(3)X3W遇水可释放出使酚酞溶液变红的气体A,该反应的化学方程式是Na3N+3H2O=NH3↑+3NaOH.
(4)同温同压下,将a L W的简单氢化物和b LZ的氢化物通入水中,若所得溶液的pH=7则a>b(填“>”或“<”或“=”).
(5)用惰性电极电解化合物XZ溶液从阴极释放出气休B,该反应的离子方程式是2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑.
(6)已知W的单质与气体B在一定条件下可形成气体A,即:W2(g)+3B(g)?2A(g)△H=-92.4kJ•mo1-1
在某温度时,一个容积固定的密闭容器中,发生上述反应.在不同时间测定的容器内各物质的浓度如下表:
①0min~10min,W2的平均反应速率0.02mol/(L•min).
②反应在第l0min改变了反应条件,改变的条件可能是ab.
a.更新了催化剂b.升高温度c.增大压强d.增加B的浓度
③若反应从第30min末又发生了一次条件改变,改变的反应条件可能是b.
a.更新了催化剂b.升高温度c.增大压强d.减小A的浓度.
 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为14,中子数为7;X的离子与NH4+具有相同的质子、电子数目:W与Y的氧化物均能导致酸雨的形成;Z的非会属性在同周期主族元素中最强.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为14,中子数为7;X的离子与NH4+具有相同的质子、电子数目:W与Y的氧化物均能导致酸雨的形成;Z的非会属性在同周期主族元素中最强.(1)Y在周期表中的位置是第三周期第ⅥA族.
(2)用电子式表示化合物X3W的结构
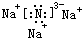 .
.(3)X3W遇水可释放出使酚酞溶液变红的气体A,该反应的化学方程式是Na3N+3H2O=NH3↑+3NaOH.
(4)同温同压下,将a L W的简单氢化物和b LZ的氢化物通入水中,若所得溶液的pH=7则a>b(填“>”或“<”或“=”).
(5)用惰性电极电解化合物XZ溶液从阴极释放出气休B,该反应的离子方程式是2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑.
(6)已知W的单质与气体B在一定条件下可形成气体A,即:W2(g)+3B(g)?2A(g)△H=-92.4kJ•mo1-1
在某温度时,一个容积固定的密闭容器中,发生上述反应.在不同时间测定的容器内各物质的浓度如下表:
| 时间 | 浓度(mo1/L) | ||
| c(W2) | c(B) | c(A) | |
| 第0min | 4.0 | 9.0 | 0 |
| 第10min | 3.8 | 8.4 | 0.4 |
| 第20min | 3.4 | 7.2 | 1.2 |
| 第30min | 3.4 | 7.2 | 1.2 |
| 第40min | 3.6 | 7.8 | 0.8 |
②反应在第l0min改变了反应条件,改变的条件可能是ab.
a.更新了催化剂b.升高温度c.增大压强d.增加B的浓度
③若反应从第30min末又发生了一次条件改变,改变的反应条件可能是b.
a.更新了催化剂b.升高温度c.增大压强d.减小A的浓度.
16.下列说法正确的是( )
| A. | CH4能使酸性KMnO4溶液褪色 | |
| B. | 金属Na能与C2H5OH中的甲基反应生成H2 | |
| C. | 乙酸有强烈的刺激性气味,其水溶液称为冰醋酸 | |
| D. | CH3CH2CH2CH3与CH3CH(CH3)2互为同分异构体 |